第四章 碳碳重键的加成反应
4.1 共价键断裂方式与有机反应基本类型
- 离子型反应:化学键异裂
\({\ce{A:B\rightarrow A+ + B-}}\) - 自由基型反应:化学键均裂
\({\ce{A:B\rightarrow A· + B·}}\) - 协同反应:化学键同步断裂与形成
\({\ce{A-B + C-D -> A-C + B-D}}\)
4.1.1 亲电试剂
亲电试剂的较低能空轨道接受电子,通路易斯酸相近,表示如下:
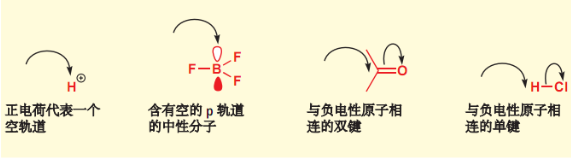
\(\ce{HX,H+,X+,X2,BH3,BF3,FeCl3,AlCl3}\)都是常见的亲电试剂。
4.1.2 亲核试剂
亲核试剂从可用的高能轨道贡献电子,同路易斯碱相近,表示如下:
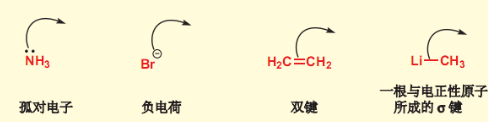
\({\ce{RO-,OH-,X-,CN-,CH3COO-,NH3,H2O,\pi 电子}}\)都是常见的亲核试剂。
4.2 烯烃和炔烃的亲电加成反应
双键/叁键
结构特点:\({\ce{C-C,C-H,C=C}}\),富电子反应特征:与亲电试剂发生加成反应
双键/叁键的反应中的会生成含有碳正离子的中间体。
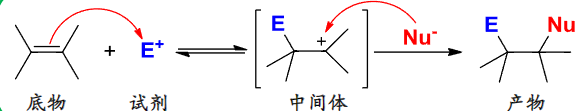
由上我们知道,进攻双键的试剂一般由正电基团和负电基团组成,两者先后进攻,打开双键。
烯烃加成反应大家族!
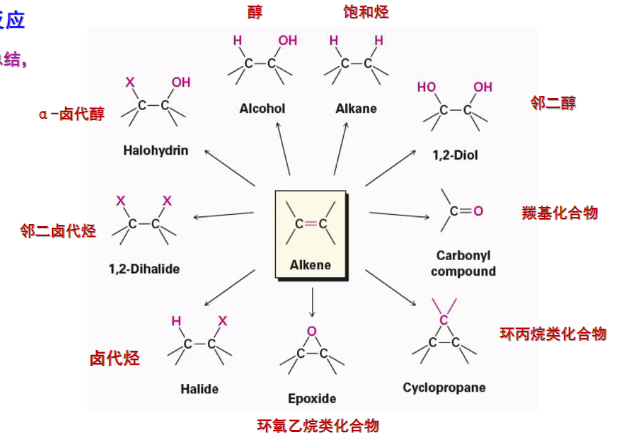
4.2.1 烯烃与卤化氢加成
卤化烃加成
+ 亲电试剂:\(\ce{HX}\) + + 亲电进攻——\({\ce{H+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
我们举一个简单的反应作为例子:
影响其反应速率的因素有:
- 卤化氢酸性:\({\ce{HI>HBr>HCl}}\)
- 双键电子云密度:比如取代的甲基越多,反应速率越快
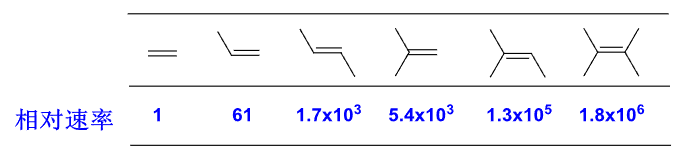
- 中间体稳定性:在加成中,中间体的碳正离子越稳定,反应速度越快
对于非对称的烯烃加成,其加成的方式会有选择性,具体遵循马氏规则。
马氏规则
亲电加成时,亲电试剂的氢加到双键碳原子上含氢多的一端。具体表现为:
- H加在含氢多的碳上 - 卤素加在含氢少的碳上 - 导致生成较稳定的碳正离子中间体
4.2.2 有机反应机理
有机反应机理的表示方式如下:
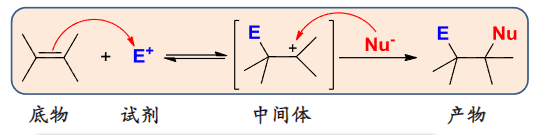
有机反应机理
- 分步反应,决速步
- 过渡态的结构应与碳正离子中间体近似 - 结构相似,能量相近 - 碳正离子越稳定,过渡态势能越低,反应越快
一个可以展示反应过程机理的反应能势图如下:
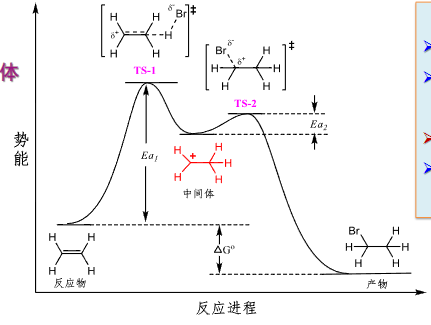
值得注意的是,过渡态(TS-1等)\({\neq}\)中间体。
过渡态与中间体的区别
- 过渡态:能量最高点,寿命极短,不可分离 - 中间体:能量相对较低,寿命较长,某些情况下可分离 - 过渡态是一个瞬时状态,中间体是一个亚稳态物质
我们同样可以借助前面已经学过的共振式的类似方法来判断某种反应历程的难易程度
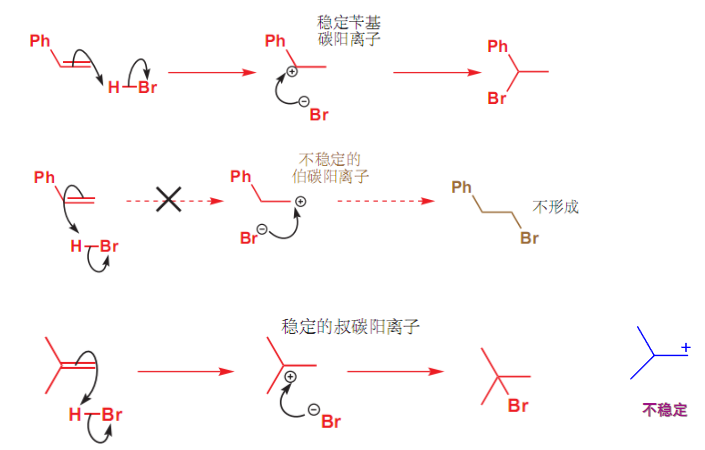
4.2.3 碳正离子的结构和稳定性
碳正离子的稳定主要依靠的是:
- 分散碳正离子的正电荷:
- \({\sigma - p}\)超共轭效应
- 诱导效应
- 满足碳正离子的平面结构:
- 所以一些桥环化合物中的桥头碳几乎不可能成为碳正离子
分散正电荷,如我们以前所学的一样,有诱导效应与共轭效应两种方式,在此简略而过。
有关于第二点的满足平面结构,可见下图例子:
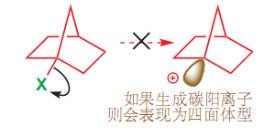
在小的桥环化合物上,桥头碳正离子没办法满足其的平面结构,所以极难形成。
4.2.4 亲电加成反应的区域选择性解释
结合前文所讨论的内容,我们可以这么解释马氏加成的本质:
由以上,得到马氏规则的推广:
所以不难有结论:越富电子的烯烃,碳正离子中间体越稳定,反应速度越快
Attention
马氏规则也不是万能的,后文会提到,如果一个反应中加成的过程与卤化氢为代表的“正先负后”的两步反应,很有可能其是不遵循马氏规则的!!!
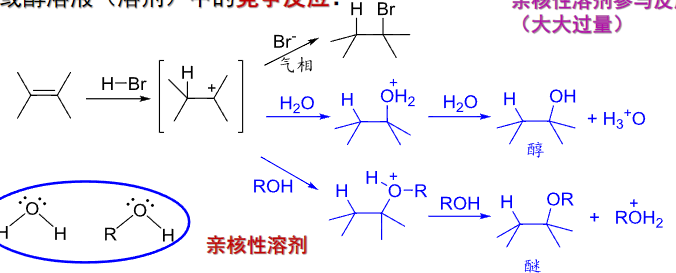
4.2.5 在水或醇溶液中的竞争反应
卤化烃加成
+ 亲电试剂:\(\ce{HX、H2O}\)、 + + 亲电进攻——\({\ce{H+}}\) + + 亲核进攻——\({\ce{X- 、OH-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
加成反应中出现的碳正离子中间体并不会老老实实等着试剂的负电部分来进攻,实际上,四周还有一堆虎视眈眈的溶剂!
众所不周知,水\({\ce{H2O}}\)和醇\({\ce{R-OH}}\)都是典型的亲核试剂,它们极有可能趁其不备,直接进攻!产生一些意想不到的副产物。
4.2.6 碳正离子重排
有机化学经常出意外……
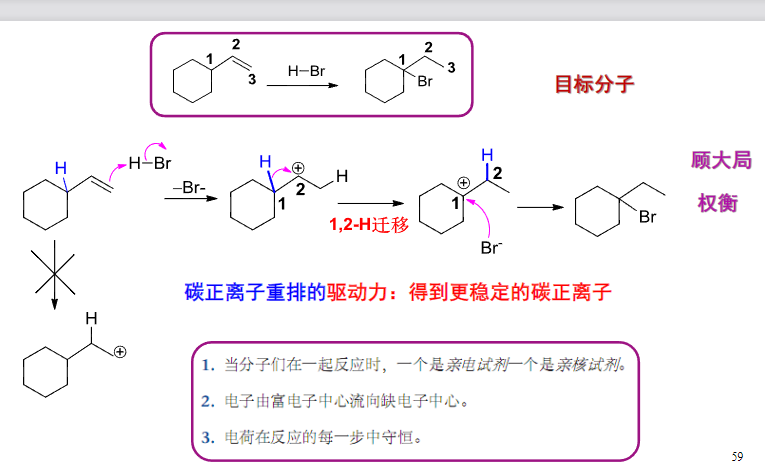
最后的产物与我们原本预料的不同,是因为这里发生了碳正离子重排。在这种情况下,会发生类似于共振结构中的正电荷转移,最终使得这个碳正离子达到足够稳定的结构后,再被亲核进攻。
4.2.7 炔烃和卤化氢的加成
卤化烃加成
+ 亲电试剂:\(\ce{HX}\) + + 亲电进攻——\({\ce{H+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
其也遵循马氏规则,其也可以稳定在仅加成一次。
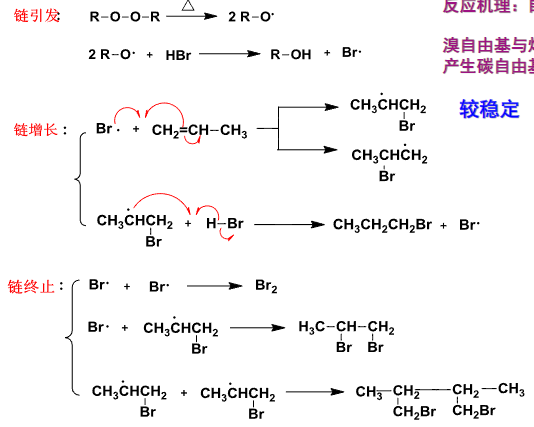
4.2.8 过氧化物效应下的HBr加成
HBr加成 | 过氧化物效应
+ 加成试剂:\(\ce{HX}\) + 区域选择性:反马氏规则 + 立体选择性:顺式加成该反应主要生成卤代烃。
与前文主要是\({\ce{H+}}\)进行亲电进攻不同,本小节将介绍比较特殊自由基的加成反应。
特别地以\({\ce{HBr}}\)举例:
在过氧化物的作用下,原本的溴化氢\({\ce{HBr}}\)均裂为两个自由基,其中\({\ce{H·}}\)与过氧化物反应,\({\ce{Br·}}\)则进攻烯烃双键。
自由基更有链式反应的特点:
Attention
需要注意的是,只有\({\ce{HBr}}\)才会在过氧化物的作用下发生这种自由基加成反应,而\({\ce{HCl}}\)和\({\ce{HI}}\)并不会表现出这一效应!!!
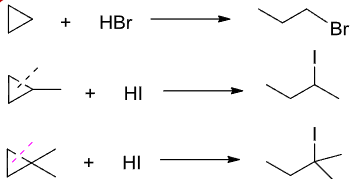
4.2.9 小环与卤化氢的加成
小环的卤化氢加成
+ 亲电试剂:\(\ce{HX}\) + + 亲电进攻——\({\ce{H+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
对于小环来说,对其加成比较特殊,其结果通常是使其开环。
Attention
此加成对五元环,六元环等大环不适用!!!
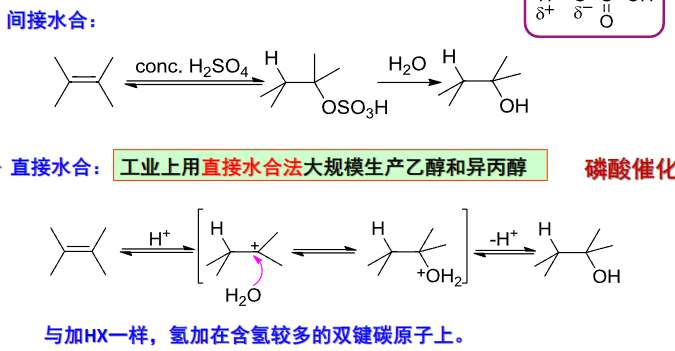
4.2.10 烯和炔的水合反应
烯烃/炔烃的水合反应
+ 亲电试剂:\(\ce{H2SO4}\) + + 亲电进攻——\({\ce{H+}}\) + + 亲核进攻——\({\ce{-OSO3H^-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应第一步与硫酸反应,生成磺酸化合物,第二步与水反应,磺酸基被取代为羟基,最终生成醇。
烯烃与\({\ce{H2SO4/H2O}}\)加成反应——水合反应:
4.2.11 烯与卤素的加成
卤素加成
+ 亲电试剂:\(\ce{X2}\) + + 亲电进攻——\({\ce{X+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成二卤素取代的烃类。
卤素反应活性:\({\ce{F2>Cl2>Br2>I2}}\)
同前一样,富电子烯烃反应活性高,速度快。
由于卤素为相同的双原子分子,与前文的卤化氢相比缺少了区域选择性,但是其存在立体选择性!!!
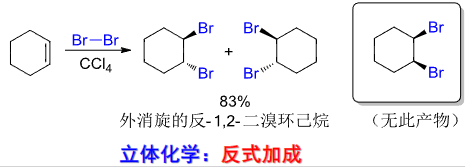
其反应机理如下:
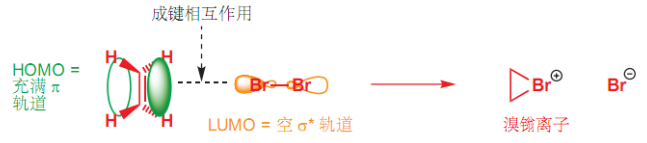
由上机理,我们可尝试解释为什么这种加成具有立体选择性
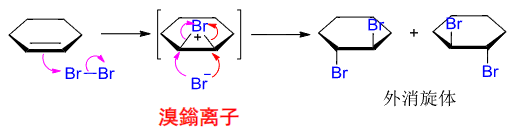
而氯的立体选择性比较差:
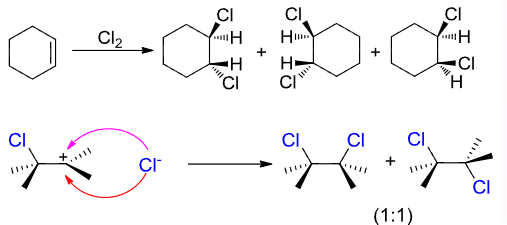
4.2.12 在水或醇存在下烯烃与卤素反应
水/醇体系下烯烃与卤素加成
+ 亲电试剂:\(\ce{X2}\) + + 亲电进攻——\({\ce{X+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
与前文提到的在水或醇充当溶剂的条件下,烯烃与炔烃和卤化氢的加成反应类似,同样在水或醇充当溶剂的条件下,烯烃与卤素的反应同样可能被水或醇“插手”。
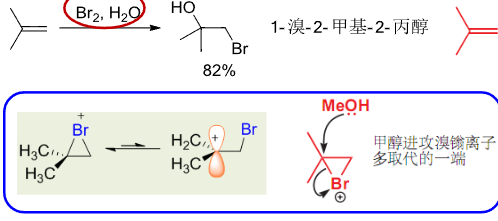
亲电试剂\({\ce{X+}}\)加在含氢多的碳上,亲核试剂\({\ce{OH-}}\)加在含氢少的碳上。
当然,此时也会生成二溴取代物,但很多时候我们将其视为一个副产品,那如何减少这种副产品的生成呢?
答案就是采用NBS——N-溴代丁二酰亚胺,其结构式如下:
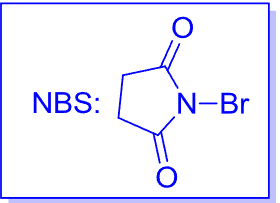
其通过共轭效应等稳定了\({\ce{Br}}\)原子,减缓了\({\ce{Br+}}\)的释放,降低了体系浓度,使得二溴取代物的产物大大减少:
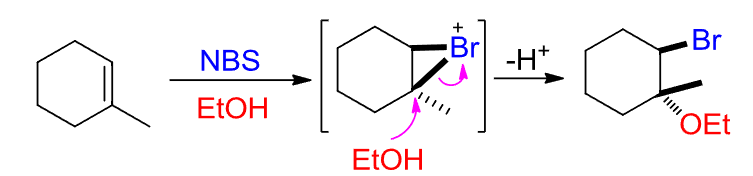
Tips
NBS指的是—N-溴代丁二酰亚胺,拓展一下,NIS自然指的就是—N-碘代丁二酰亚胺啦~
4.2.13 炔烃和卤素加成
炔烃与卤素加成
+ 亲电试剂:\(\ce{X2}\) + + 亲电进攻——\({\ce{X+}}\) + + 亲核进攻——\({\ce{X-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应主要生成卤代烃。
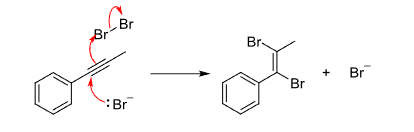
炔烃与卤素的加成含有特殊的协同加成机理
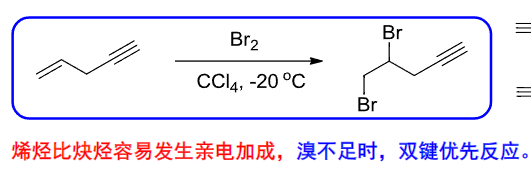
特别的,将烯烃和炔烃进行对比,前者亲电加成的反应活性更高:
4.2.14 环丙烷与卤素加成
与前文类似,点此跳转
4.2.15 共轭双烯的亲电加成反应
卤化氢加成
+ 亲电试剂:无指定 + + 亲电进攻——正离子部分 + + 亲核进攻——负离子部分 + 区域选择性:马氏规则 + 立体选择性:无该反应存在两种加成情况,一种是共轭双烯两侧加成,一种是单独对一个双键加成。
示意图如下:
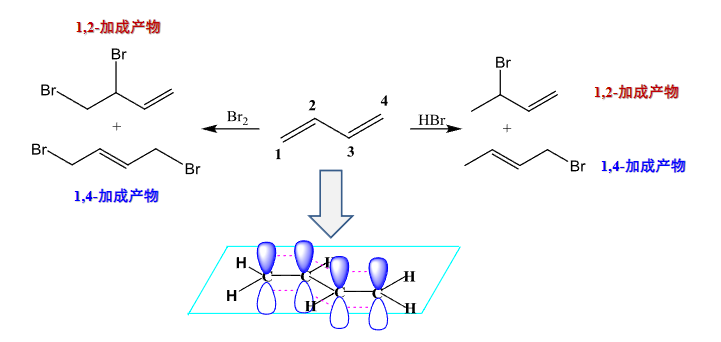
特别的,对于上面两种加成路径,其最终产物占比与温度的关系如下表:
| 1, 2-加成 | 1, 4-加成 | |
|---|---|---|
| 0℃ | 71% | 29% |
| 40℃ | 20% | 80% |
这是为什么?让我们来看看反应过程中的反应势能图:
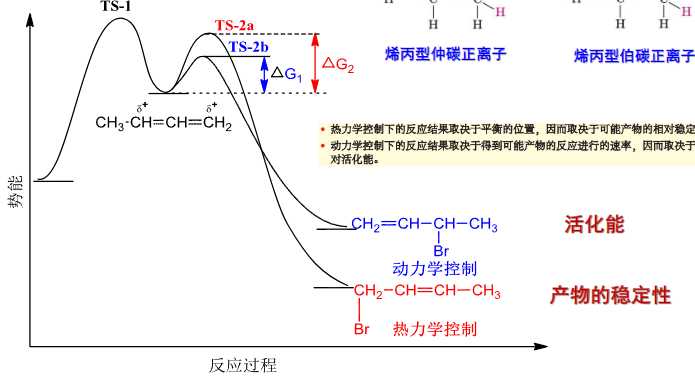
由于过渡态的稳定性不同,两个反应路径的活化能不同,最后产物的稳定性不同,导致了这个加成反应出现了热力学和动力学上两者的分歧。
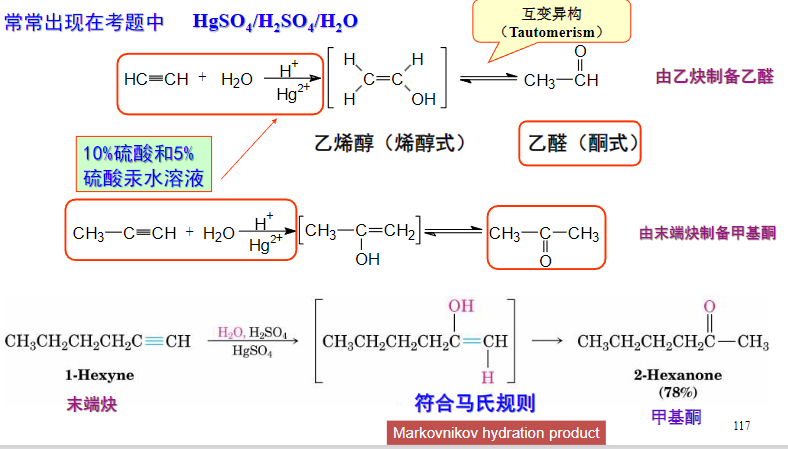
4.2.16 烯烃/炔烃与醋酸汞和水的加成
烯烃/炔烃与醋酸汞和水的加成反应也称为羟汞化-还原反应。
羟汞化-还原反应
+ 亲电试剂: + + 亲电进攻——\({\ce{HgOAc+}}\) + + 亲核进攻——\({\ce{OH-}}\) + 区域选择性:马氏规则 + 立体选择性:反式加成该反应与烯烃主要生成醇,与炔烃主要生成酮。
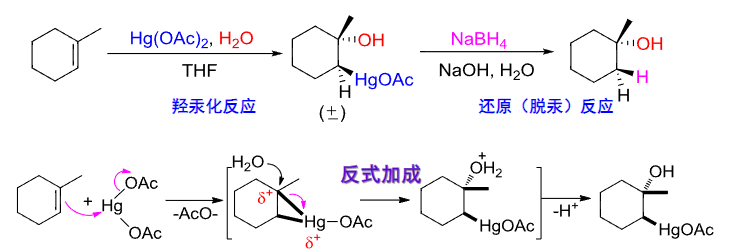
值得注意的是,这里既有区域性选择性——马氏规则,也有立体选择性——反式加成。
对于炔烃的反应则会自动脱汞,而不需要额外还原剂的介入:
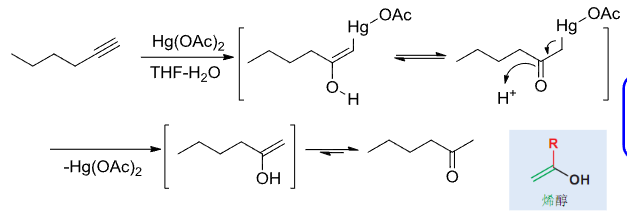
特别的,可以通过汞离子的催化效应来由乙炔制备乙醛:
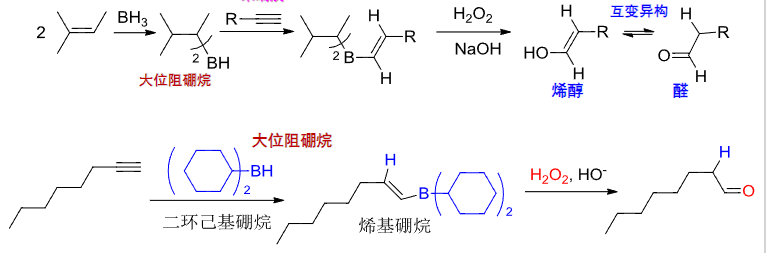
4.2.17 烯烃/炔烃加硼烷
卤化氢加成
+ 亲电试剂:\(\ce{BH3}\)等一系列的硼氢化合物 + 区域选择性:反马氏规则 + 立体选择性:顺式加成该反应第一步硼氢化合物参与双键加成,第二步由\(\ce{H2O2}\)参与氧化脱去硼,插上羟基。
该反应也称为硼氢化-氧化反应,\({\ce{BH3}}\)上存在空轨道,是一个亲电试剂。
对于烯烃来说,一般这个反应分为两步进行,第一步是硼氢化反应:
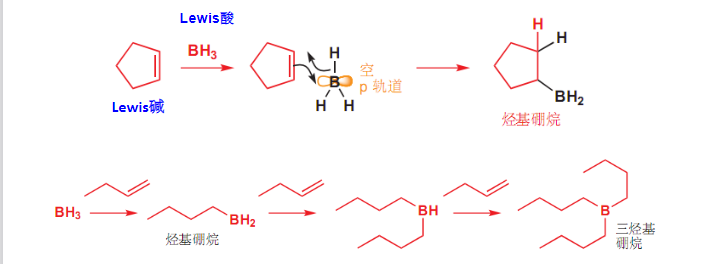
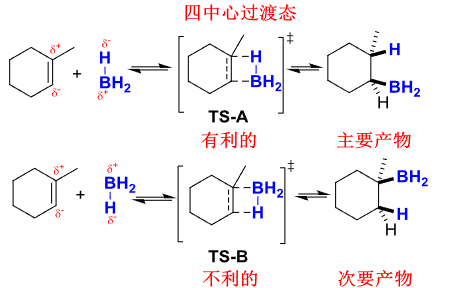
这一步是一次到位的,并没有出现碳正离子,第一步反应的细节如下
第二步是氧化反应:
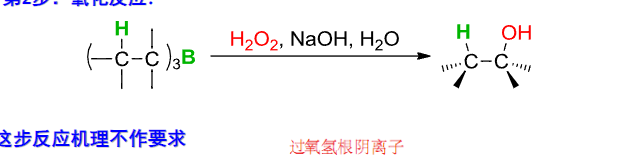
这个反应会将硼摘下来,换成羟基。
总的来说,这反应变成了双键与\({\ce{H2O}}\)的反马氏加成,类型是顺式加成
对于炔烃来说,其反应总体上与烯烃相同,但是由于最后氧化完会出现一个烯醇式结构,最终的产物会是个酮或者醛:
4.3 Diels-Alder反应(双烯合成)
卤化氢加成
+ 亲电试剂:缺电烯烃 + 立体选择性:顺式加成 + 底物:富电烯烃该反应主要生成环化合物。
DA反应的特殊之处在于,其的亲电试剂变成了缺电子烯烃/炔烃,而被进攻的底物是富电子的双烯体。

缺电子和富电子的影响因素,不过就是联系我们之前学过的电子效应和共轭效应。
同前文所提的硼氢化-氧化反应类似,DA反应的加成过程是一步到位,同时发生的,其是顺式加成。
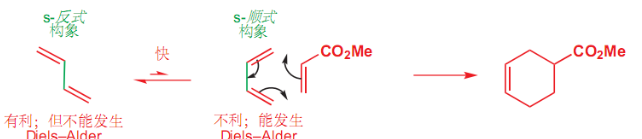
4.3.1 双烯体的构象要求
DA反应中有一个很特别的点,就是其双烯体的顺反构象要求:
- 顺式双烯:不利构象,但是可以发生
- 反式双烯:有利构象,但是很难发生
4.4 烯烃和炔烃的加氢反应
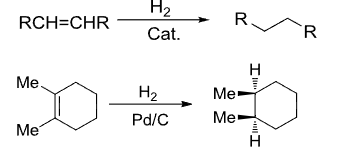
4.4.1 烯烃的催化加氢
烯烃催化加氢
+ 加成试剂:\({\ce{H2/D2}}\) + 催化剂:\({\ce{Pd}}\) + 区域选择性:无 + 立体选择性:顺式加成该反应与烯烃主要生成烷烃
4.4.2 炔烃的催化加氢
炔烃催化加氢
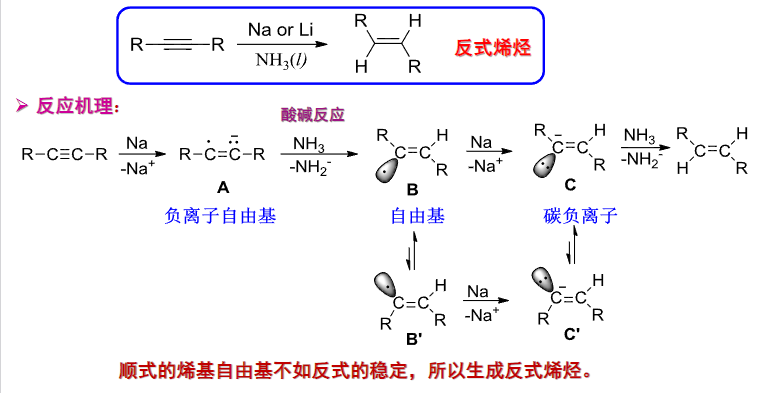
+ 加成试剂:\({\ce{H2/D2}}\) + 催化剂:\({\ce{Pd、Li{+}NH3(l)、Na{+}NH3(l)}}\) + 区域选择性:无 + 立体选择性:顺式/反式加成该反应与炔烃主要生成烷烃(直接使用\({\ce{Pd}}\)催化)、顺式烯烃(\({Lindlar\ \ce{Pd}}\))、反式烯烃(\({\ce{Li{+}NH3(l)、Na{+}NH3(l)}}\))
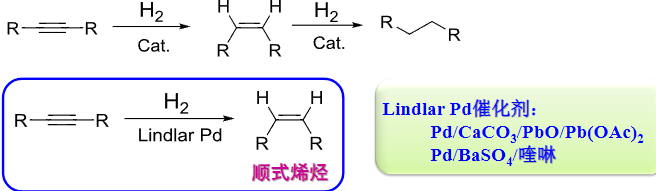
其中Lindlar表示活性较低的催化剂。使得加成停留在只加成一次。
使用锂或钠,配合液氨催化可以得到反式加成的产物。
4.5 烯烃和炔烃与氧的加成反应
4.5.1 双羟化反应和氧化断裂反应
烯烃和炔烃催化加氧与高锰酸钾
+ 加成试剂:\({\ce{KMnO4}}\) + 催化剂:无 + 区域选择性:无 + 立体选择性:顺式加成该反应与高锰酸钾的浓度和酸碱性有较大关系,见下具体讨论
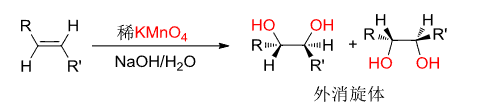
- 稀的/碱性\({\ce{KMnO4}}\)氧化:主要生成双羟化产物,顺式加成。
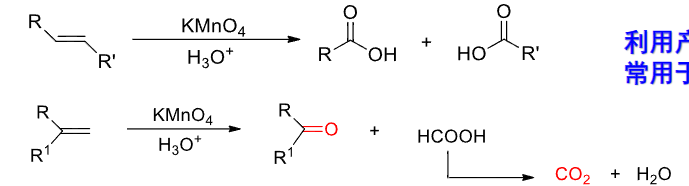
- 中性/酸性\({\ce{KMnO4}}\)氧化:主要生成酮或羧酸或放出\({\ce{CO2}}\)(取决于双键位置)
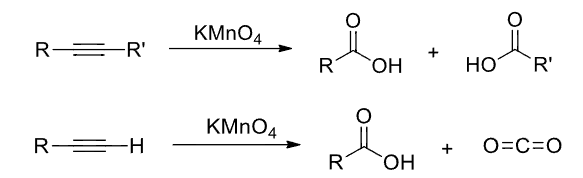
- 炔烃与\({\ce{KMnO4}}\)氧化:生成两个羧基;如果是末端炔烃,则末端碳转化为二氧化碳。
\
烯烃和炔烃催化加氧与四氧化锇
+ 加成试剂:\({\ce{OsO4}}\) + 催化剂:无 + 区域选择性:无 + 立体选择性:顺式加成该反应主要生成顺式加成的双羟基化产物,有碱性/稀的高锰酸钾的既视感。
有水体系下:
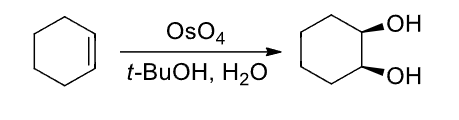
无水体系下:
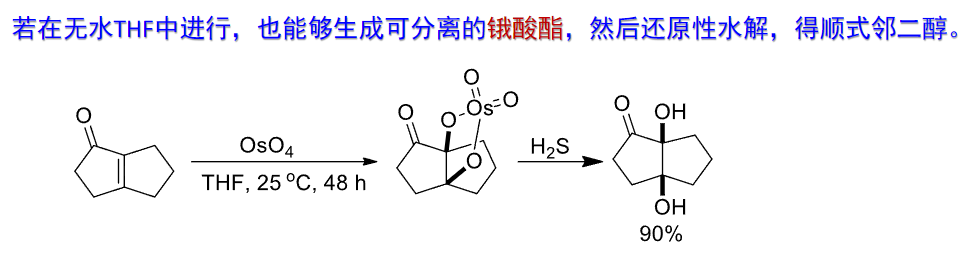
4.5.2 环氧化反应
烯烃的环氧化反应
+ 加成试剂:过氧化物(\({\ce{RCO3 H、 H2O2、ROOH}}\)等等) + 催化剂:无 + 区域选择性:无 + 立体选择性:顺式加成该反应主要生成环氧化物
具体反应机理如下:
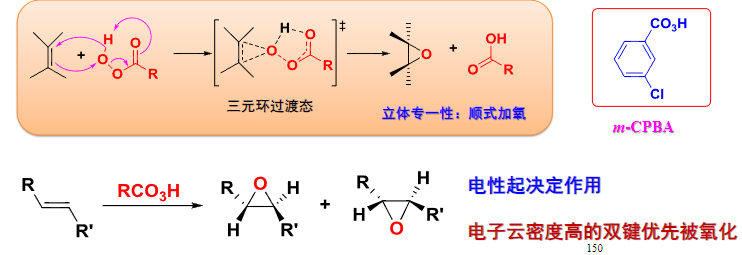
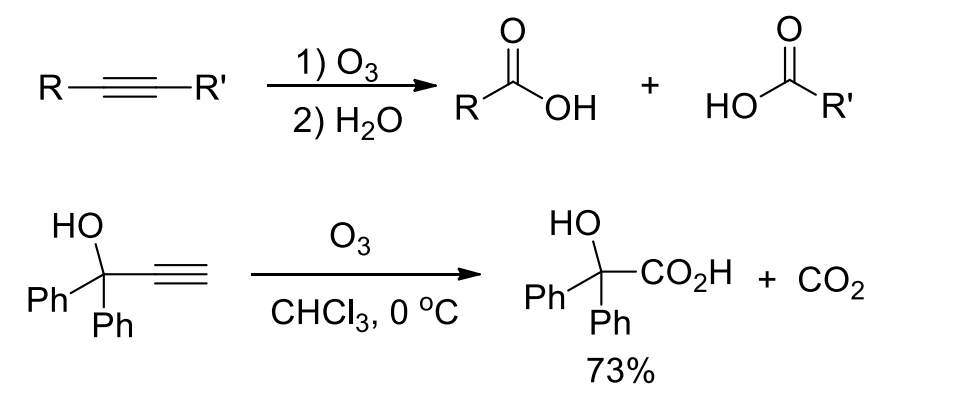
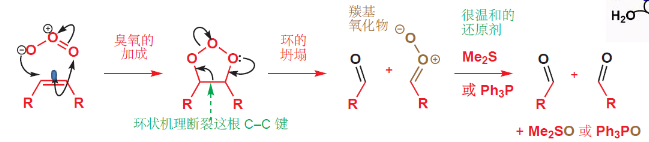
4.5.3 臭氧化——还原水解反应
臭氧氧化-还原反应
+ 加成试剂:\({\ce{O3}}\) + 催化剂:无 + 区域选择性:无 + 立体选择性:无该反应对于烯烃来说,是将双键拆分开来,生成两个羰基;对于炔烃来说,是将三键拆开,生成两个羧基,如果是末端炔烃,则末端碳转化为二氧化碳。
反应举例如下:
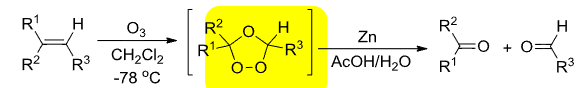
机理如下:
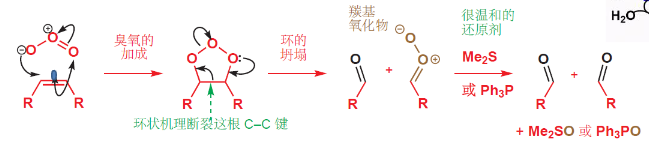
如果采用比较“激进”的还原剂……
对于炔烃来说,其臭氧化得到两个羧酸,末端炔烃得到羧酸和\({\ce{CO2}}\)