第六章 芳香烃
6.1 芳香烃的类型与命名
芳香烃
具有芳香气味的芳香类物质,与脂环烃相比,具有高度的不饱和性,稳定性很强,容易发生取代反应,不易进行加成氧化反应,具有芳香性。
6.1.3 多环芳烃同分异构和命名
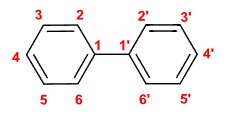
- 联苯:
- 萘:
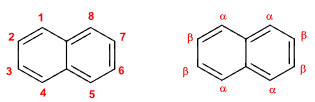
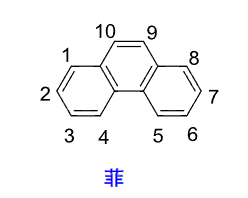
- 菲:
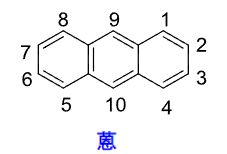
- 蒽:
6.2 苯的结构与稳定性
苯的特点是——易取代,难加成,这个特点来自于其特殊的共振结构:
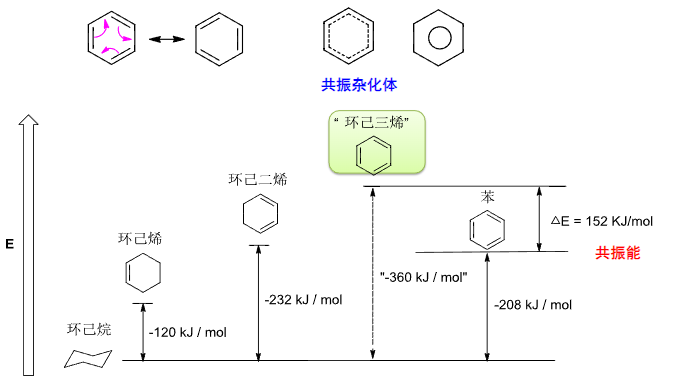
苯环上的碳原子都采取\(sp^2\)杂化,存在垂直于平面的\(p\)轨道电子,形成一个\(\ce{\Pi^6_6}\)的离域大π键。
而以苯环为代表的芳香烃因为此种特殊的结构,会形成环状的电子流——其直接贡献了芳香性。
6.4 芳环上的亲电取代反应
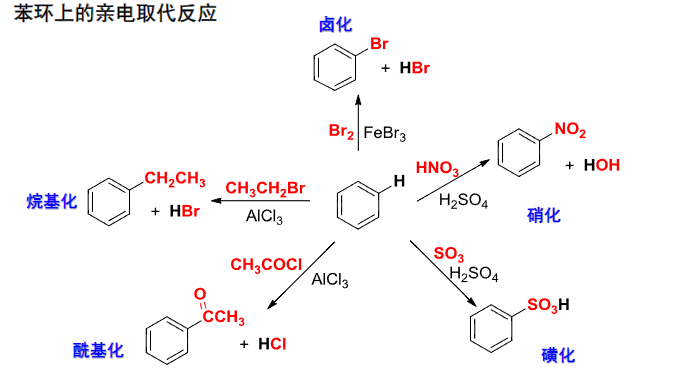
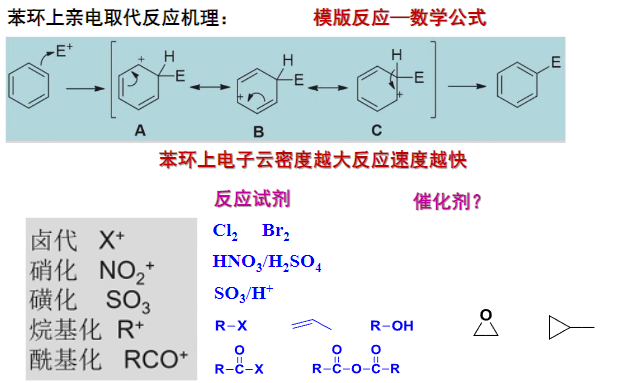
常见的亲电试剂:\(\ce{X2,HNO3,SO3,RX,RCOCl\dots}\)
常用的催化剂:\({\ce{H2SO4,Lewis酸}}\)
下图展示了催化剂在反应中所起到的作用:
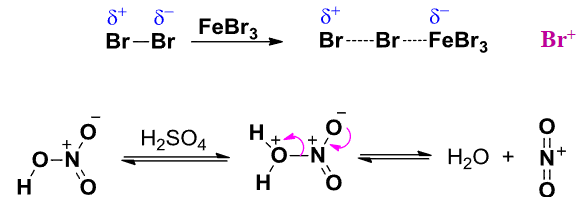
其的参与促进了强亲电试剂的生成。
亲电试剂与芳香烃(这里特别以苯环举例)的反应机理如下:
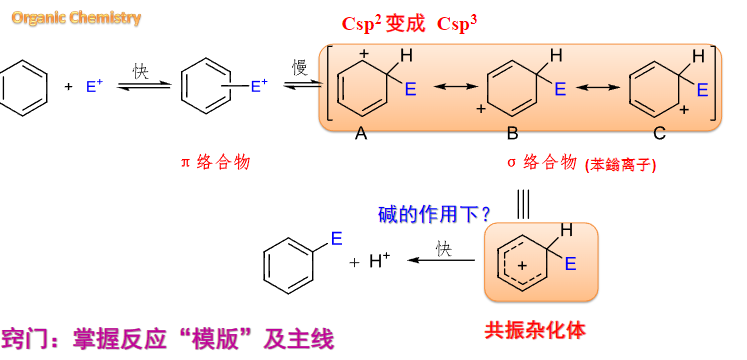
亲电试剂先与大\(\pi\)键反应形成\(\pi\)络合物,之后转化为\(\sigma\)络合物,形成一个共振杂化体,最后脱去一个\(\ce{H}\),形成最终的产物。
值得注意的是,这个反应的限速步骤是\(\sigma\)络合物的生成。
6.4.1 卤化反应
卤化反应
+ 亲电试剂:\(\ce{X2}\) + 催化剂:\(\ce{FeX3/Fe}\)该反应主要生成卤代芳香烃。
其反应机理如下:
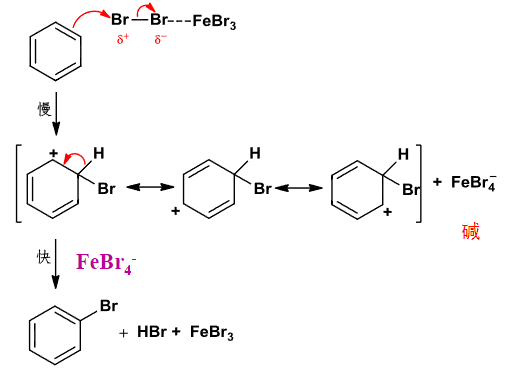
在催化剂的作用下,卤素形成强亲电试剂,进攻大\(\pi\)键,形成\(\sigma\)络合物,在碱(\(\ce{FeX4-}\))的作用下最后脱去一个\(\ce{H}\),生成最终产物。
反应势能图:
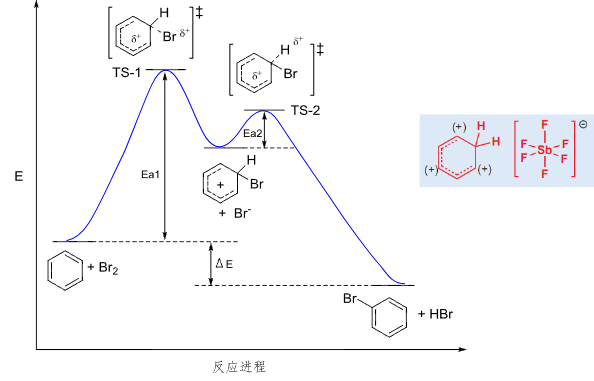
卤代反应中,\(\ce{F2}\)的活性太强,难以控制,而\(\ce{I2}\)的活性太弱,难以发生反应。
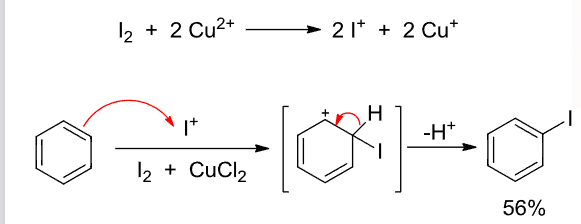
但是我们可以用\(\ce{ICl}\)或\(\ce{I2 + CuCl2}\):
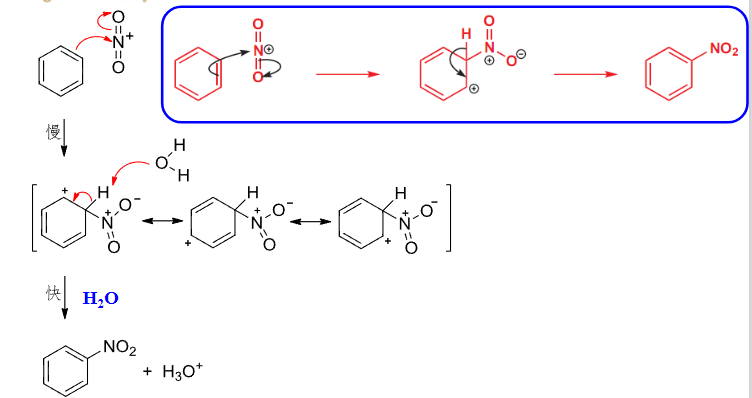
6.4.2 硝化
硝化反应
+ 亲电试剂:浓\(\ce{HNO3}\) + 催化剂:浓\(\ce{H2SO4}\) + 温度:\(50\sim60^\circ C\)该反应主要生成硝基芳香烃。
此间催化剂的作用是:
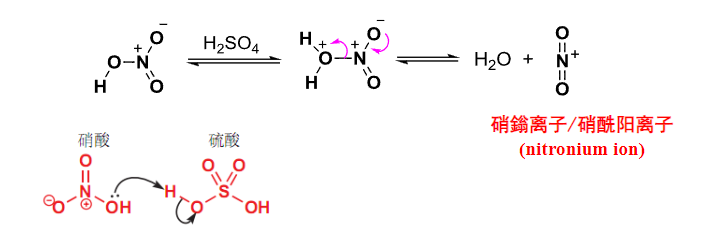
反应机理如下:
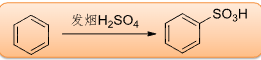
6.4.3 磺化反应
磺化反应
磺化反应是\(\ce{H2SO4}\)或\(\ce{SO3}\)在\(\ce{H2SO4}\)中将芳香化合物转化为芳香磺酸的反应。
- 亲电试剂:\(\ce{SO3H+/SO3}\)
- 催化剂:发烟\(\ce{H2SO4}\)
- 温度:\(150\sim180^\circ C\)
该反应主要生成磺酸酯。
其反应机理如下:
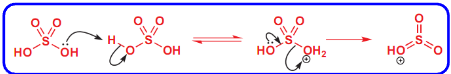
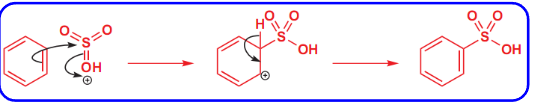
这个过程中发烟硫酸自己活化了自己,形成了强亲电试剂。
原PPT过于混乱,这里截全图展示:
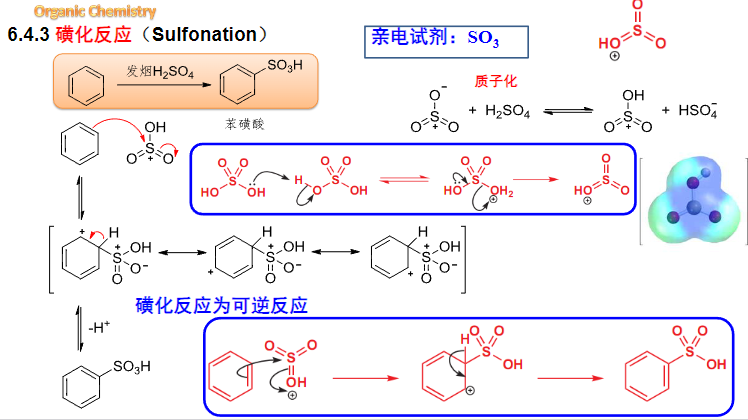
可见还有另一种的反应途径解释,但本质差不多,不过是亲电进攻时候反应物的不同。
特别地,磺化反应为可逆反应。
由于这个特殊的性质,磺化反应可以用来:
- 保护基团:
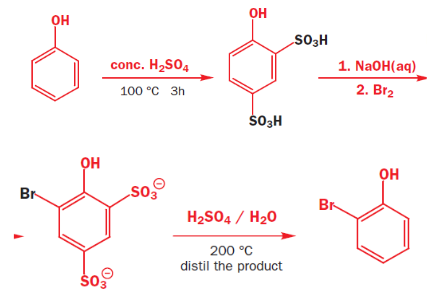
- 制备酚类化合物:
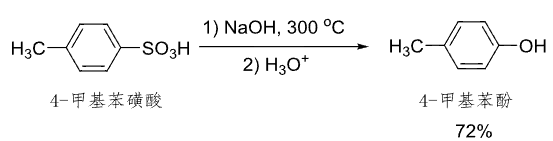
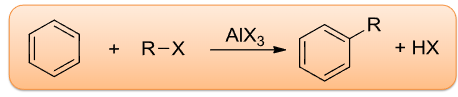
6.4.4 Friedel-Crafts烷基化反应
Friedel-Crafts烷基化反应
+ 亲电试剂:烷基卤化物\(\ce{R-X}\) + 催化剂:\(\ce{AlX3、HF、BF3}\)等路易斯酸该反应主要生成烷基取代的芳香烃。
其反应机理如下:
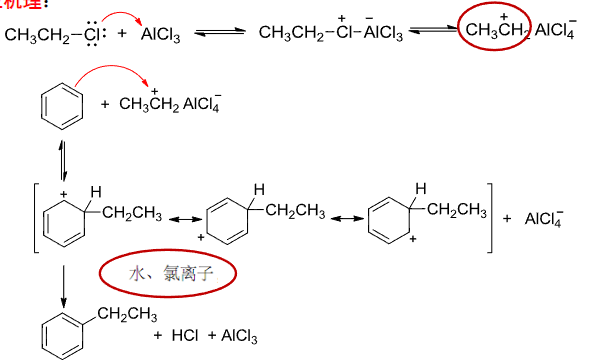
以下反应同样属于Friedel-Crafts烷基化反应
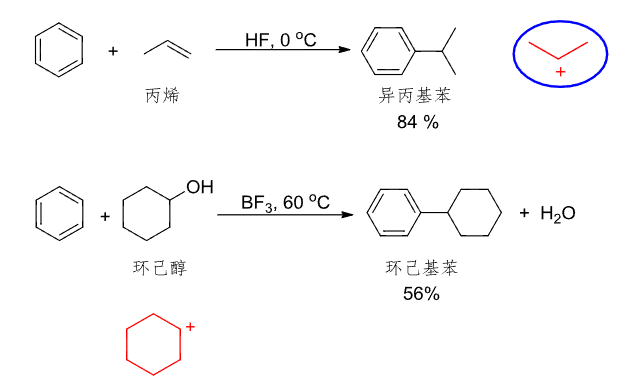
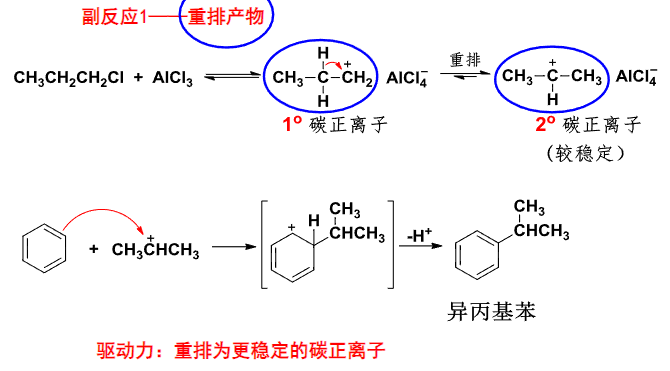
其中生成了碳正离子,自然会有重排反应的发生:
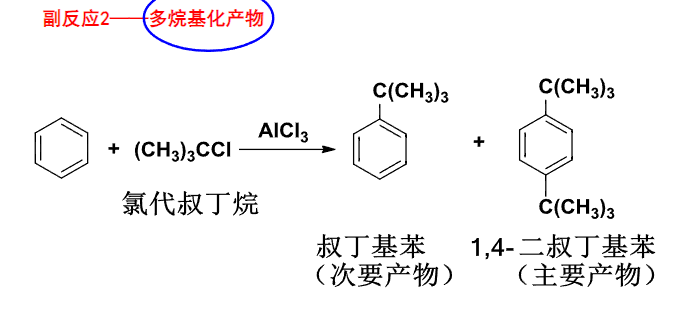
也可能存在多取代产物:
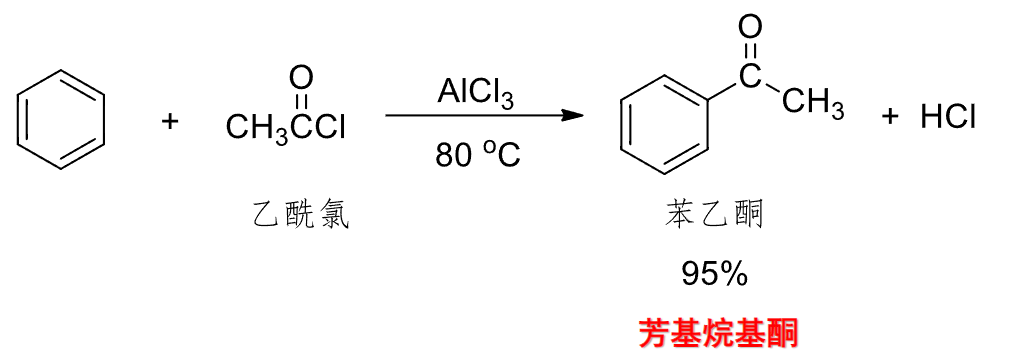
6.4.5 Friedel-Crafts酰基化反应
Friedel-Crafts酰基化反应
+ 亲电试剂:酰卤化物\(\ce{RCO-X}\) + 催化剂:\(\ce{AlX3、HF、BF3}\)等路易斯酸该反应主要生成酰基取代的芳香烃。
其反应机理如下:
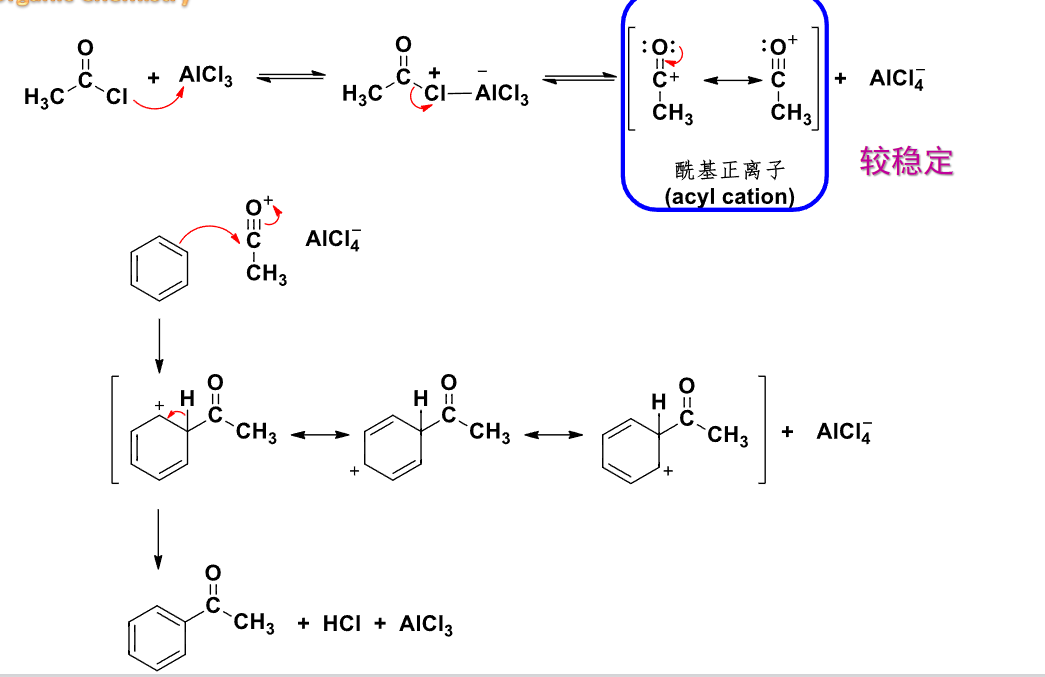
特别注意,芳环上连有强吸电子基团及有配位作用的基团时候,不能进行Friedel-Crafts反应。
- 强吸电子基团:\(\ce{NO2、^+N(CH3)、CF3、SO3H}\)
- 配位基团:\(\ce{NH2}\)
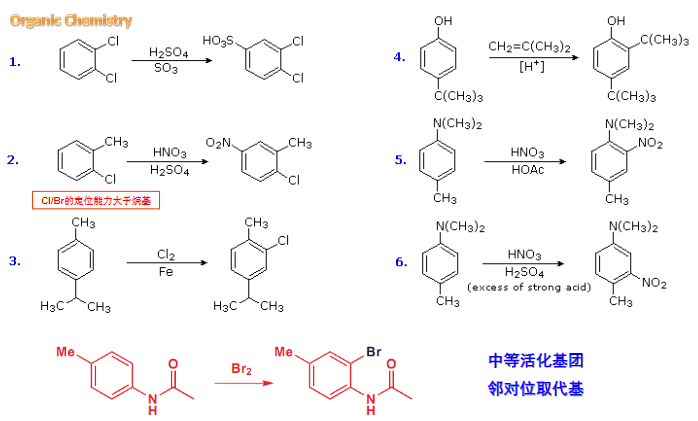
6.5 亲电取代的反应活性与区域选择性
典型的具有反应活性例子如下:
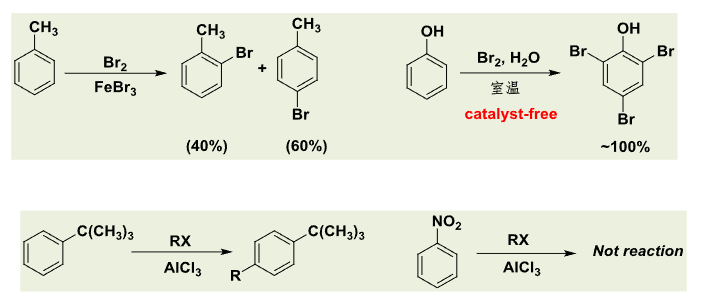
典型的区域选择性的例子如下:
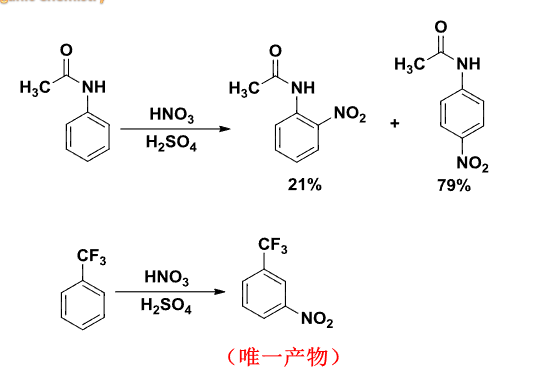
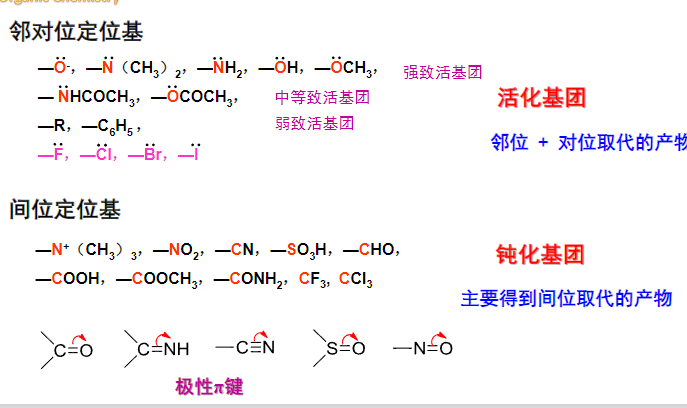
6.5.1 单取代笨的亲电取代反应的定位规律和反应活性
根据苯环上的单取代基的反应活性不同,可以分为以下三种情况:
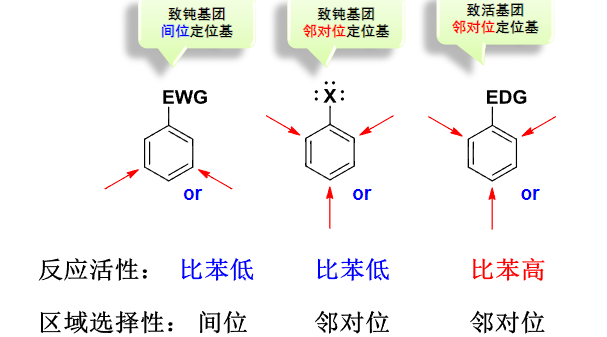
那么反应活性如何划分呢,见下图:
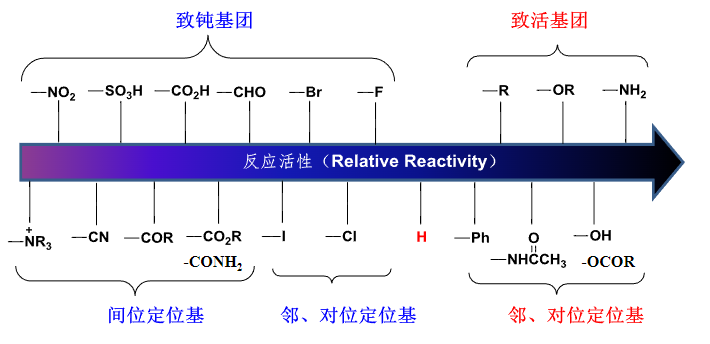
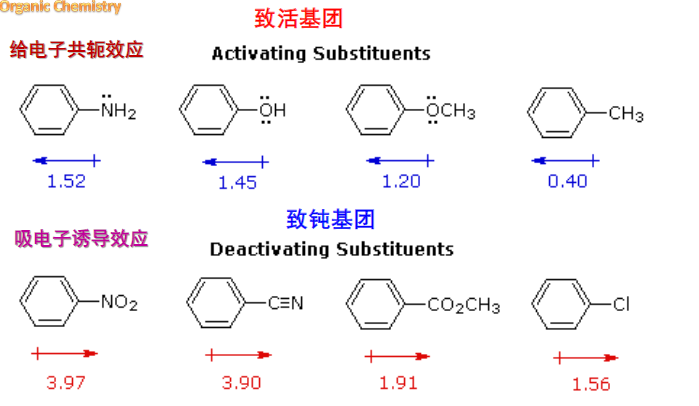
这个致钝或是致活基团的底层原理是已经讨论过无数次的诱导效应和共轭效应:
共轭效应:
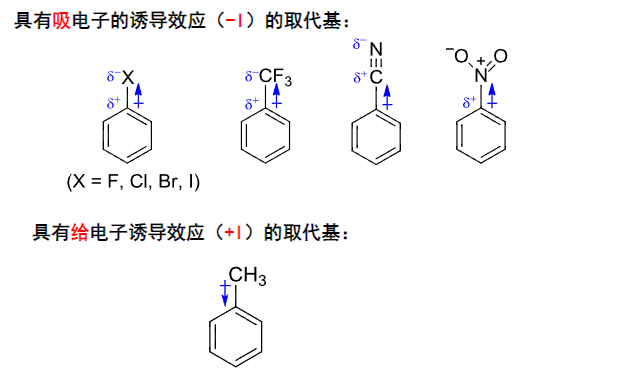
诱导效应:
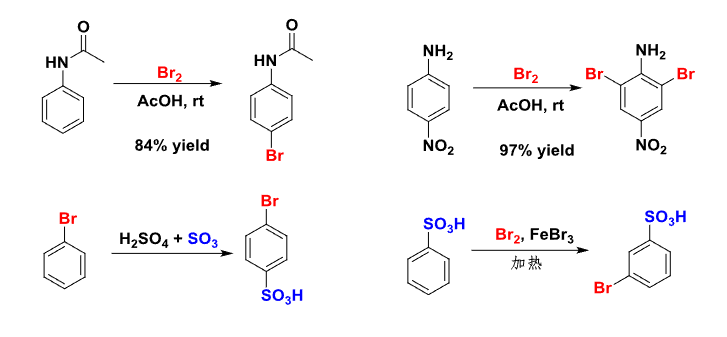
举例如下:
6.5.1.1 底物的电子云分布情况
通过画出单取代苯的共振杂化体,我们往往可以判断出这基团取代后,亲电取代是倾向于邻对位还是间位:
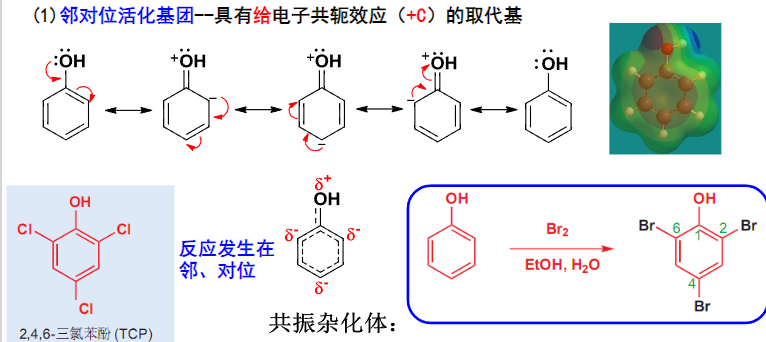
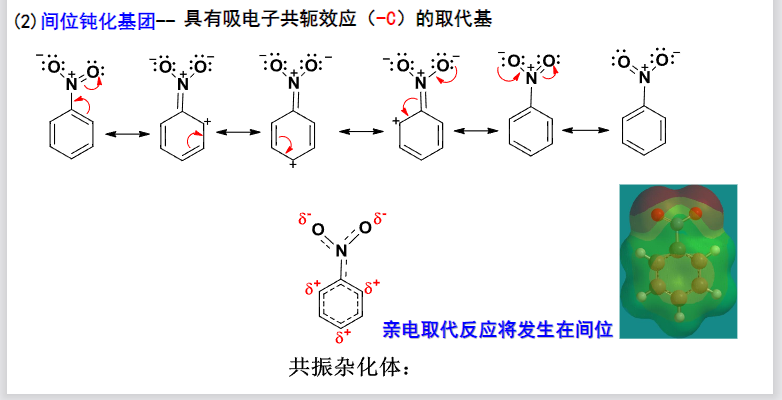
我们可以发现,具有给电子共轭效应(\(\rm{+C}\))或吸电子共轭效应(\(\rm -C\))的取代基,会导致苯环上的邻对位与间位之间的电子云密度发生差异,从而影响亲电取代发生的位置。
6.5.1.2 分析中间体的稳定性
同之前研究其他反应一样,我们同样可以通过反应中间体的稳定性来入手,中间体越稳定,反应越容易进行,相应产物越容易生成。
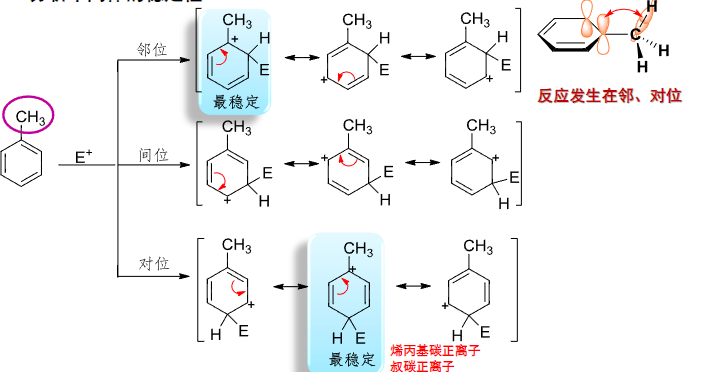
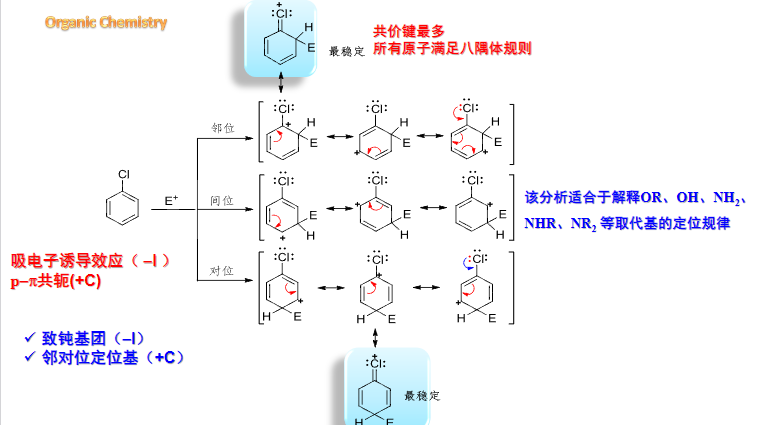
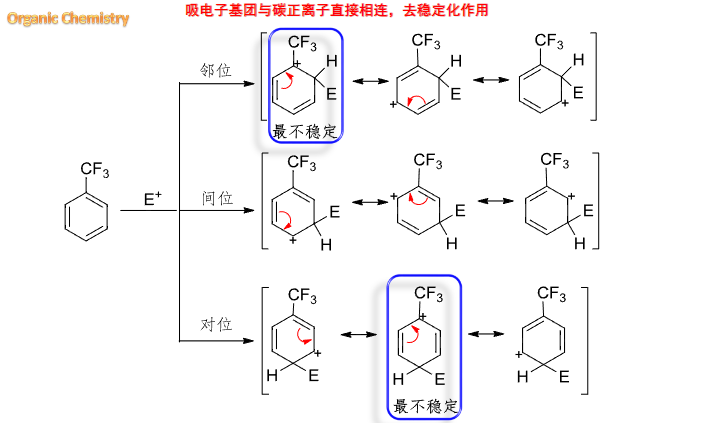
6.5.1.3 总结
- 取代基定位效应:
-
- 分析反应物苯环碳原子电子云密度(部分电荷d+/d-)
-
- 分析中间体的相对稳定性
- 分析/判断方法:
-
- 邻、对位定位基
-
- 间位定位基
6.5.2 二取代苯的定位规律
二取代苯的定位规律是两个基团的总效应,其大致要考虑如下两点:
- 最强致活基团控制定位权
- 空间位阻大的位置难取代
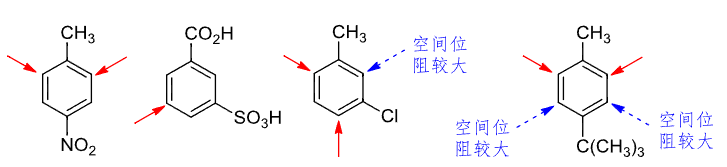
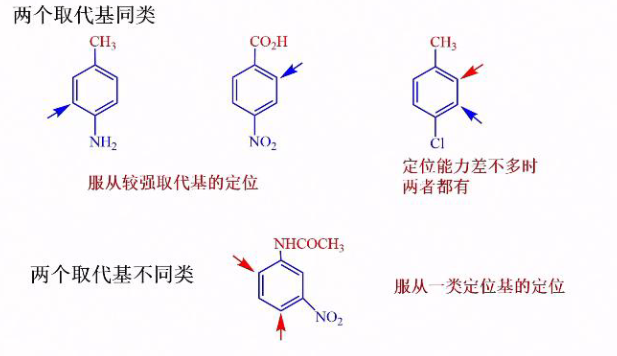
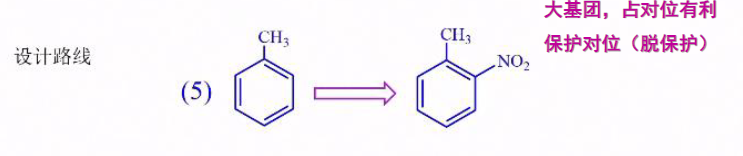
利用二取代之间的关系,可以设计相应路线合成想要的产物:
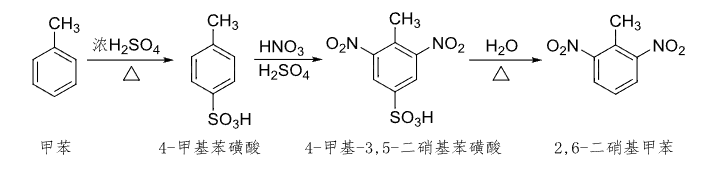
- 合成邻硝基甲苯:
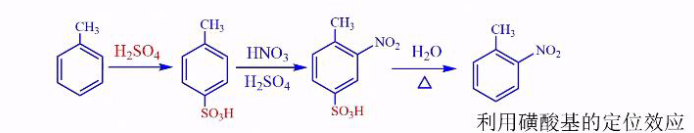
- 合成邻二硝基苯甲酸:
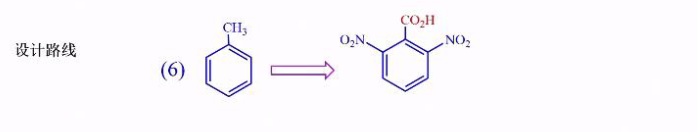
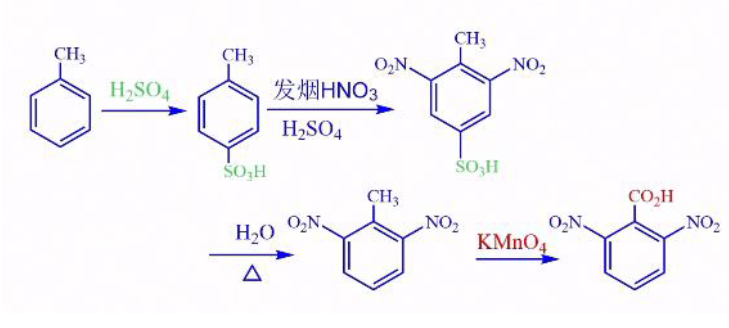
这里也运用到了之前讲过的,磺酸化反应可逆的重要性质。
6.5.3 多环芳烃的定位规律
6.6 芳烃的氧化还原反应
6.6.1 氧化反应
首先,苯环不容易被氧化,所以少打人家主意。
我们一般考虑侧链的氧化反应:
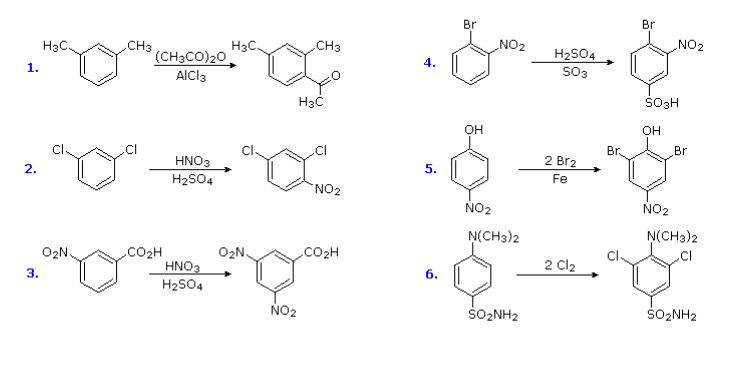
对于烷基侧链的氧化,\(\alpha-\rm{C}\)上必须要有氢!!!
6.6.2 还原反应
还是别打苯环主意,一般都是侧链先还原:
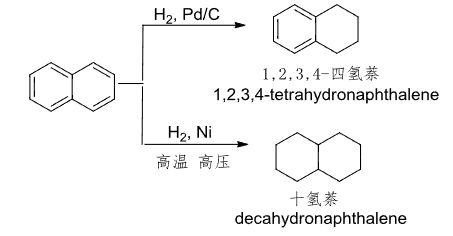
多环芳香化合物有可能发生环上的还原:
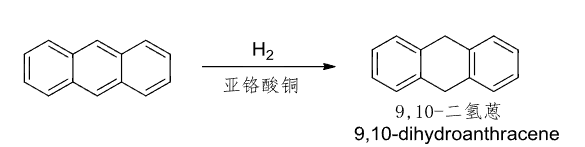
因为萘和蒽的芳香性不如苯。
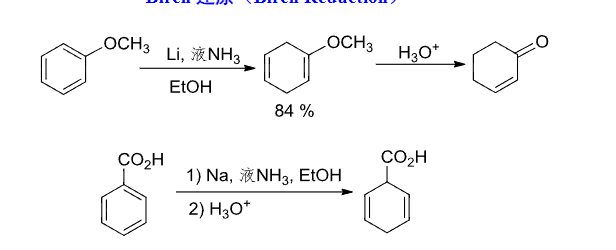
6.2.3 Birch还原
Birch还原机理如下:
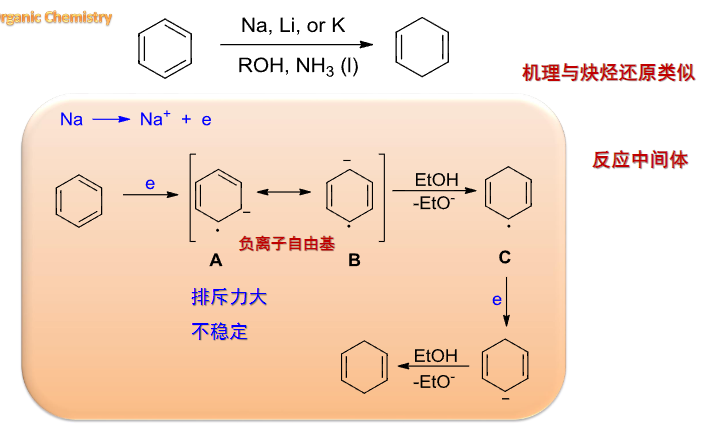
一般规律:
+ 给电子基团可导致还原速度减慢; + 吸电子基团使还原速度加快,所得产物中取代基位于被还原的碳上。
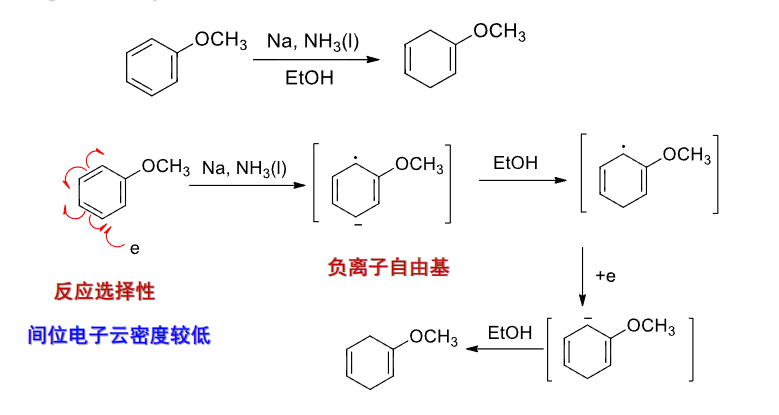
Birch还原的产物也会受到环上取代基的印象,如果取代基是一个致活基团,那么间位电子云密度低,可见下图:
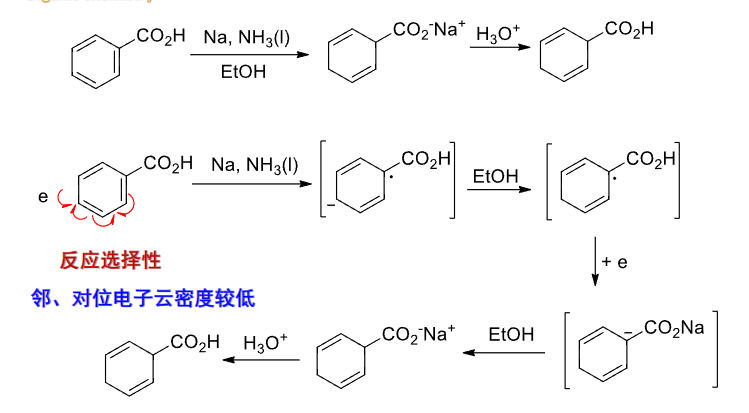
如果是一个致钝基团,那么情况相反,邻对位电子云密度低,可见下图:
6.7 芳香性
芳香性
对于特定的平面环来说,具有特别稳定的性质,倾向于取代而非加成。