第二章 脂肪烃和脂环烃
2.1 脂环烃的分类和构造异构
对于脂环烃的分类,我们有如下分类方式:
2.2 同系列和异构现象
同系列(analog):
一系列碳数不同,但是性质相似的有机化合物,比如烷烃一类,烯烃一类和炔烃一类。同系物(analogous):
同系列中的每个成员被称为同系物。
2.2.1 同系列
2.2.1.1 烷烃
烷烃,也称为“饱和烃”,其通式为\({\ce{C_nH_{2n+2}}}\)
烷烃的代表有甲烷(\({\ce{CH4}}\))、乙烷(\({\ce{C2H6}}\))等等
2.2.1.2 烯烃
烯烃,是一种“不饱和烃”,其通式为\({\ce{C_nH_{2n+2-2m}}}\),其中m具体取决于其不饱和度。
不饱和度:
不饱和度是一种衡量有机化合物不饱和程度的指标,可回忆高中相关知识,特别是常见官能团或结构的不饱和度。
计算公式:对于分子式:\(\ce{C_nH_mX_oO_pN_q}\),其不饱和度为: \(\({不饱和度=\frac{2n+2-(m+o)+q}{2}}\)\)
2.2.1.3 炔烃
炔烃,是另一种“不饱和烃”,其通式为\({\ce{C_nH_{2n+2-4m}}}\),其中m具体取决于其不饱和度。
2.2.2 异构现象
同分异构体:
分子式相同而结构不同的化合物构造异构:
由于分子中各原子的连接方式和顺序不同产生的同分异构现象,骨架异构,官能团异构和官能团位置异构都属于构造异构。
值得注意的是,同分异构体\({\neq}\)同系物。
2.2.2.1 骨架异构
骨架异构:
由于碳骨架上碳的连接顺序不同而产生的异构
举例如下图: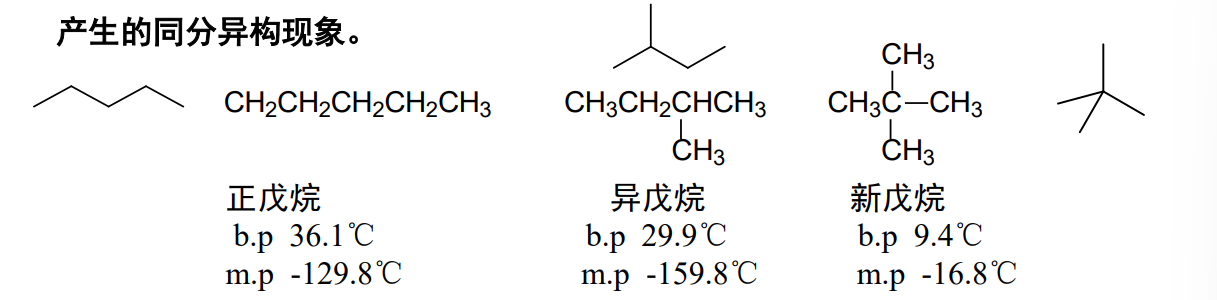
下图给出了各碳数的烷烃可能存在的异构体数目: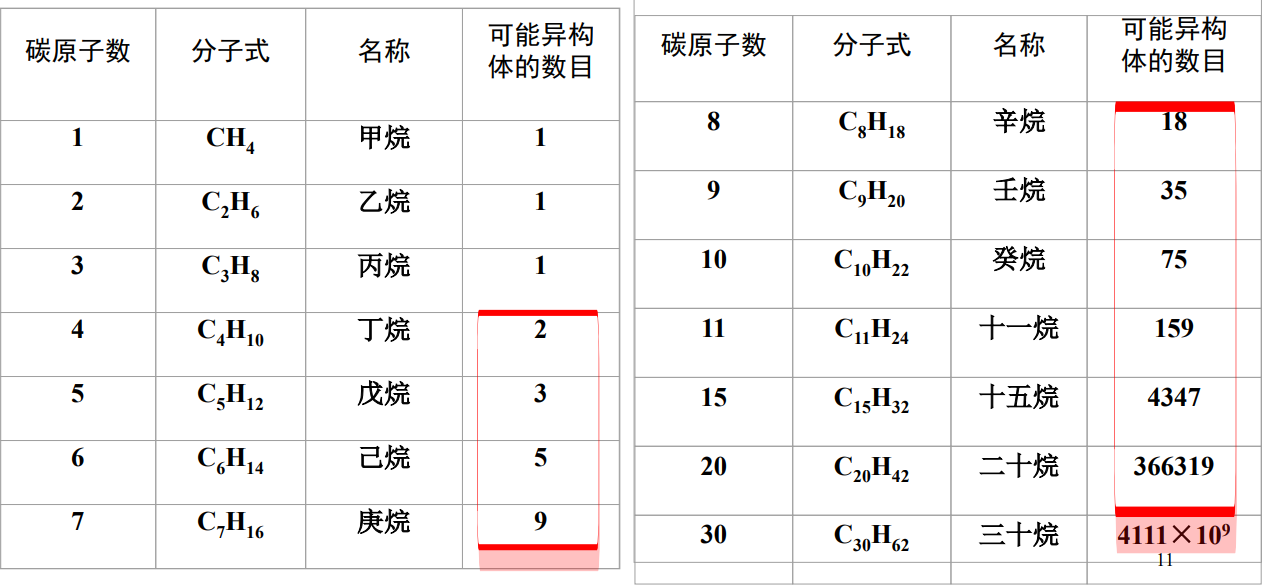
2.2.2.2 官能团位置异构
官能团位置异构:
官能团相同,但是官能团在分子中的位置不同
值得注意的是,碳链整体的“形状”应该相同,否则为构造异构,举例如下: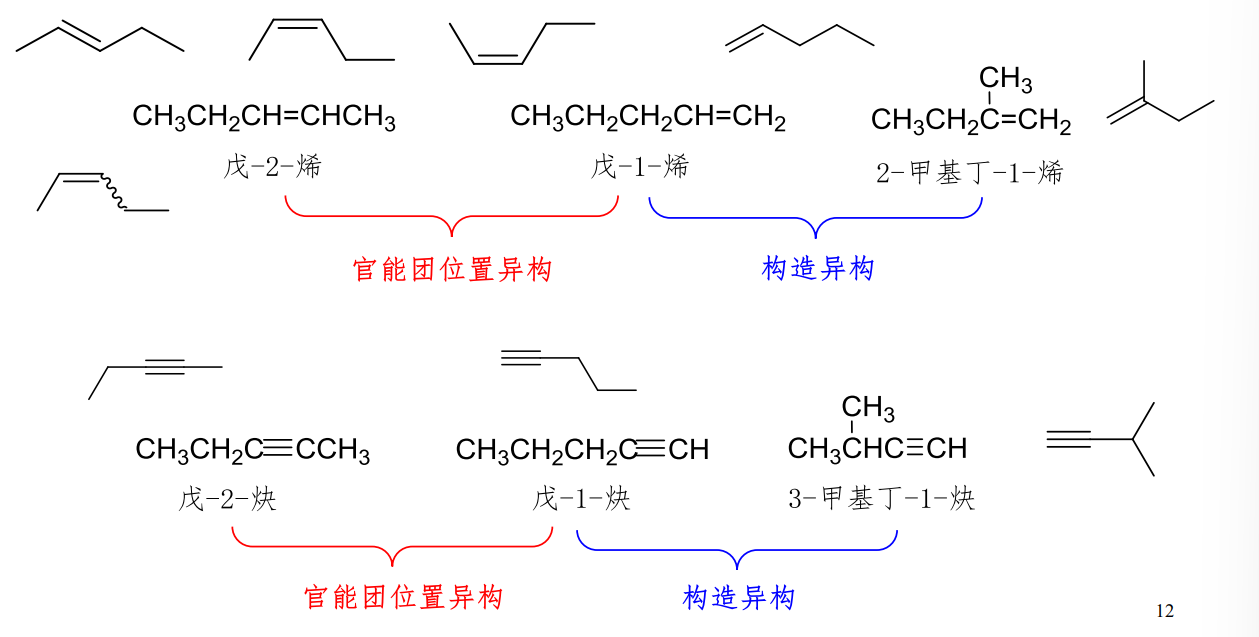
2.2.2.3 官能团异构
官能团位置异构:
分子式不变,但是官能团不同
举例如下: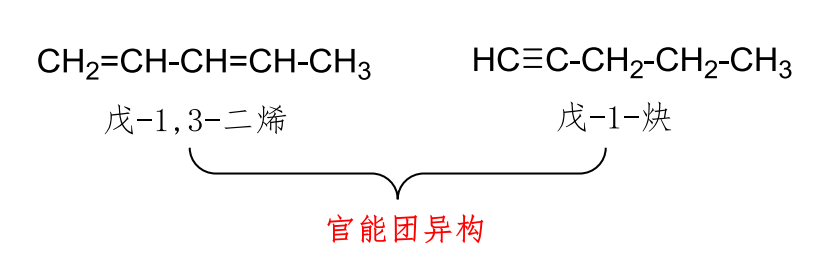
2.3 sp³杂化碳原子的四种类型
烷烃碳上的碳可分为四种:伯碳、碳仲、叔碳和季碳。具体如下:
- 伯碳(一级碳):与一个碳和三个氢相连的碳原子,记为\({\ce{1^\circ C}}\),与伯碳相连的被称为伯氢。
- 仲碳(二级碳):与两二个碳和两个氢相连的碳原子,记为\({\ce{2^\circ C}}\),与仲碳相连的被称为仲氢。
- 叔碳(三级碳):与三个碳和一个氢相连的碳原子,记为\({\ce{3^\circ C}}\),与叔碳相连的被称为叔氢。
- 季碳(四级碳):与四个碳相连的碳原子,记为\({\ce{4^\circ C}}\)。
Attention:
上文中的\({\ce{1^\circ C}}\)等记号并非摄氏度单位,其意思为“数字 + ° + 碳”
具体举例如下: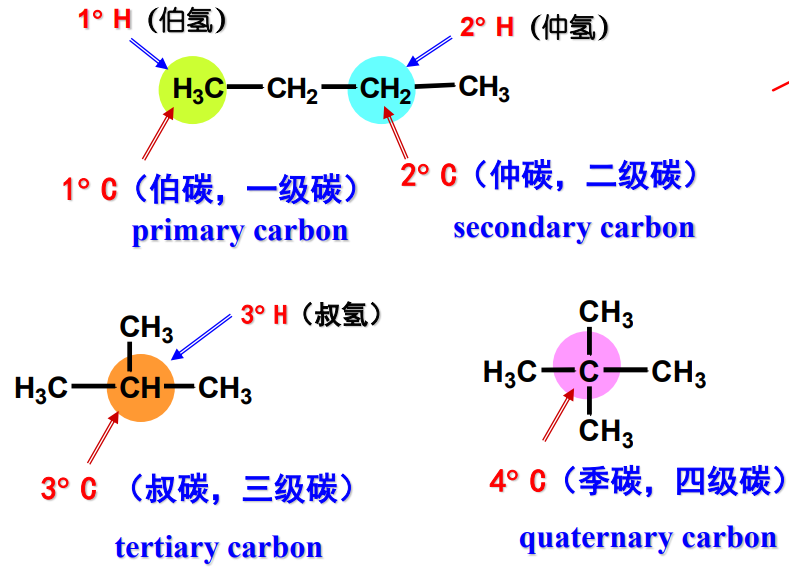
我们进一步补充不同杂化下的碳原子,其包含了自由基,正/负离子的情况: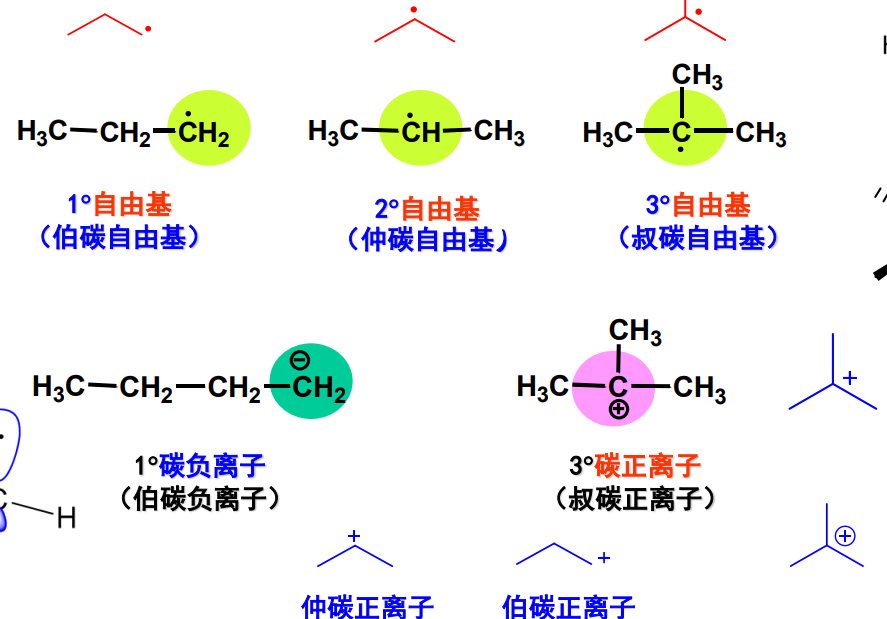
特别注意上面标注出的碳的杂化方式。
2.4 脂肪烃的命名
化合物的名称通常分为系统名、俗名和半系统名/半俗名。
脂肪烃的命名有四种命名方法:
- 系统命名法
- 普通命名法
- 衍生物命名法
- 俗名
其中系统命名法一般指的是IUPAC命名法。
2.4.1 普通命名法
普通命名法对直链脂肪烃通常为“碳数 + 烷/烯/炔”,其中碳原子数在1~10时用天干序(甲乙丙丁戊己庚辛壬癸),超过10则用中文的十一、十二等命名。
对于支链脂肪烃,则有正(表示直链,通常省略)、异(表示\(具有{\ce{(CH3)2CH{--}}}\)或\({\ce{(CH3)2C=}}\)结构)和新(表示具有\({\ce{(CH3)3C{--}}}\)结构)三种名称。
但是普通命名法有很大的局限性,特别是面对碳数更多,结构更复杂的脂肪烃时候。
2.4.2 系统命名法
系统命名法的命名结构为:“前缀 + 母体 + 后缀”,对于支链脂肪烃,其系统名即为“取代基名 + 主链 + 名”。
2.4.2.1 取代基命名
取代基:
取代有机化合物上氢原子的基团被称为取代基,对于烷烃、烯烃、炔烃,其上分别去掉一个氢原子,分别成为烷基、烯基和炔基
下放一张图直接说明常见的取代基命名: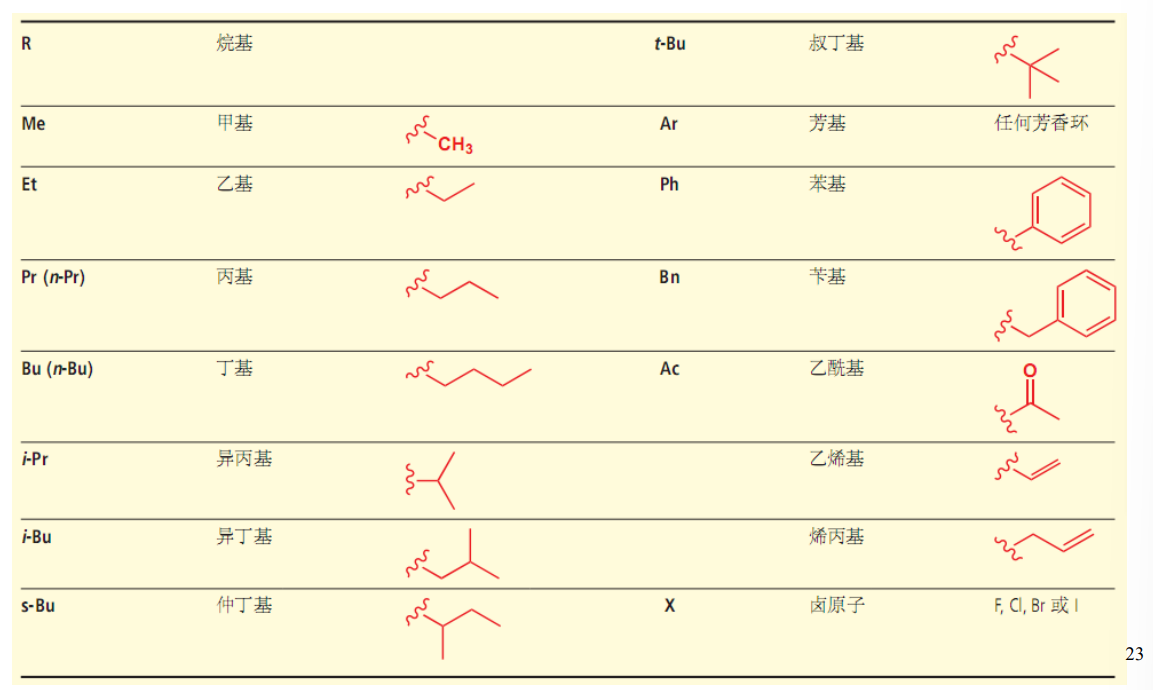
更多命名可以查询书本,这里简单略过。
2.4.2.2 有机化合物系统名的组成
这里我们详细开头所说的命名结构:
其中:
- 取代基名:支链(基团),官能团(前缀),一般按照英文首字母顺序列出
- 母体氢化物:直链烷烃/烯烃/炔烃,无取代基的脂环烃或芳香烃等,以及一些用俗名命名的化合物
- 主官能团名:主官能团(后缀),但不包括烯烃,炔烃等作为母体氢化物的官能团。
与普通命名法类似,碳原子数在1~10时用天干序(甲乙丙丁戊己庚辛壬癸),超过10则用中文的十一、十二等命名。
2.4.2.3 有机化合物命名原则
系统命名主要分三步走:
第一步:选择主链。
主链原则:
- 碳链最长
- 重键最多
- 双键最多
- 重键位次组最低
- 双键位次组最低
- 取代基(支链)最多
- 取代基(支链)位次组最低
- 取代基英文名排序在前
注意以上原则有优先级。
第二步:主链编号
按照上一步的原则,先后编号,原则越靠前者应最先被考虑,使其编号尽量低(包括成组的情况)
第三步:组名
原则如下:
- 命名结构:“取代基名(前缀)+母体氢化物(词根)+主官能团名(后缀)”
- 命名原则:按照前文对取代基,母体和官能团的命名方式进行组合,数字之间用","相隔,数字与文字之间用"-"相隔
- 特殊情况:有多个相同支链则合并,并在前以一二三等表明个数,遇上支链上还有支链的情况,则嵌套命名。
更详细的说明可见课本,总体上延续了高中的命名知识。
特别的,有以下特殊情况需要考量: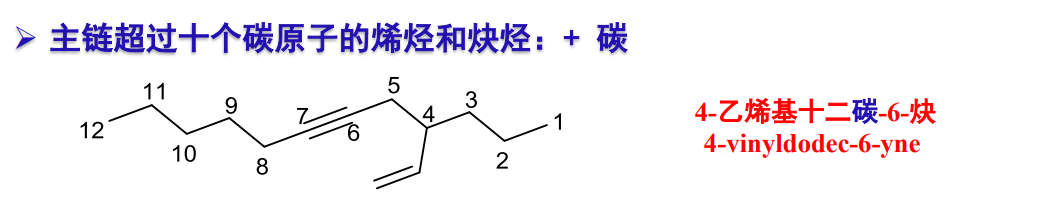
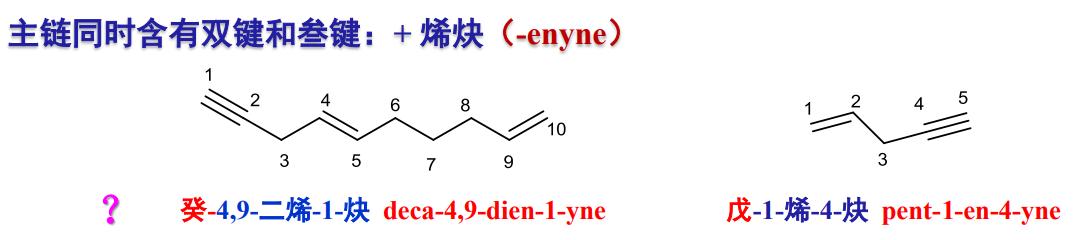
2.4.2.4 烯烃异构体标记
Attention:
不是所有的烯烃都有顺反异构,其必须保证烯基两侧上至少有两种不同的基团
方法一:顺反标记法
该种方法有所限制,其要求烯基两个碳原子上有相同基团,且要限制其旋转因素。
相同基团在同侧为顺式构型,在异侧为反式构型。
举例如下图: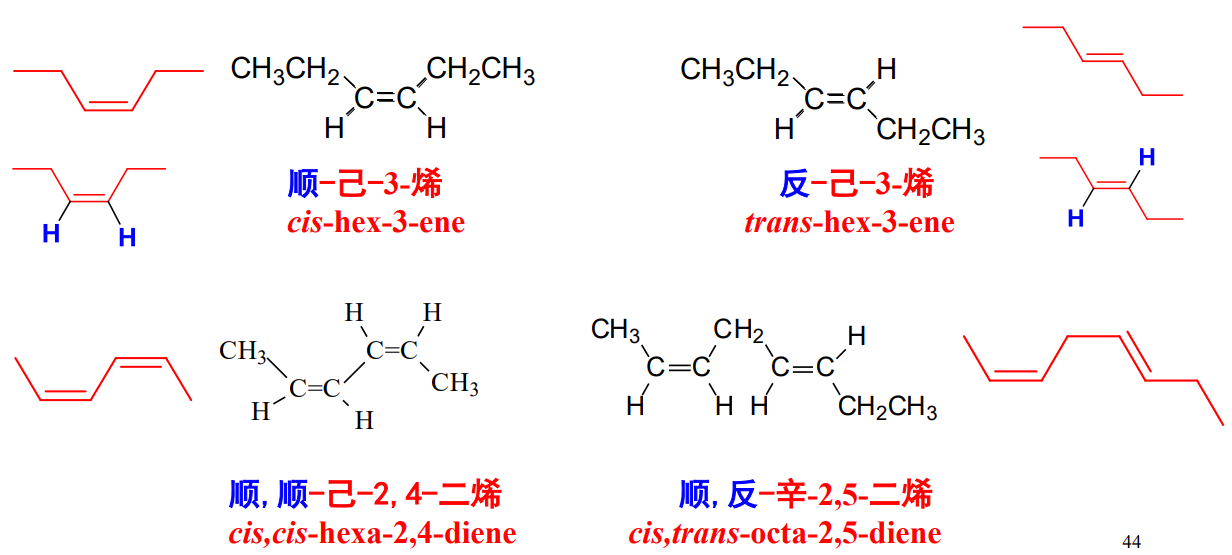
方法二:Z/E标记名法
对于满足以下次序:\({a>b \& c>d}\)的,有如下例子:
其中左侧为Z构型,右侧为E构型。
次序规则:
- 原子序数大的优先于小的
- 原子质量高的优先于小的
- 顺(cis)优先于反(trans),Z优先于E
特别地,我们一般先关注直接与烯基碳相连的原子,下面这张图很好展现了如何进行比较:
简要概括,大同边为Z,大异边为E。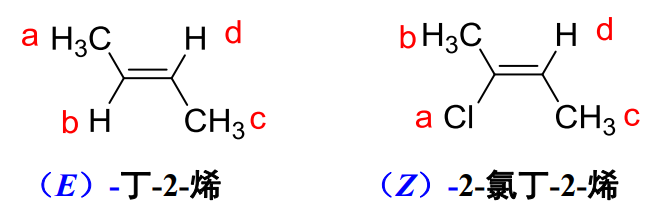
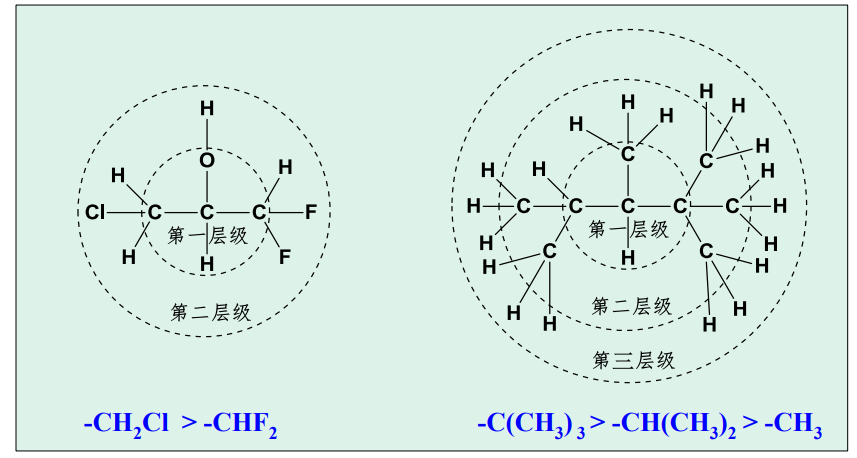
2.4.2.5 复杂基团比较
回归上方树状比较图,对于复杂基团,其可能同时属于多个层级,对此我们需要采取特殊的规则进行层级划分。
举例如下:
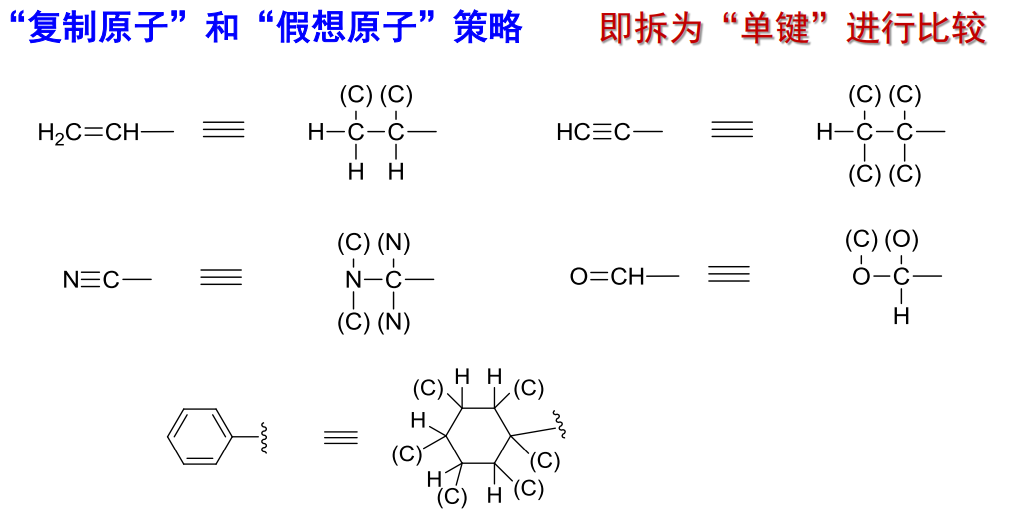
Attention:
+ "复制原子"表示在括号内 + 孤对电子可看作最小的"基团"
具体的比较例子如下:
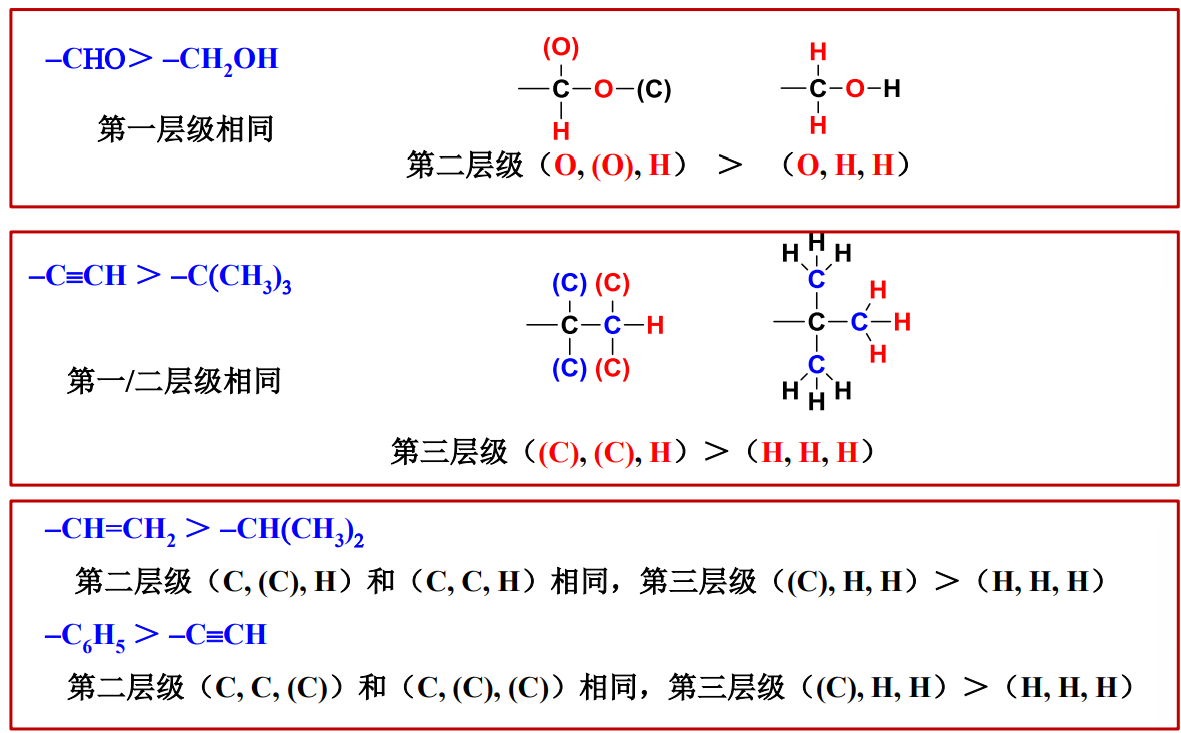
2.5 脂环烃的命名
Tips:
本节不要求完全掌握
基本步骤:
- 确定主链:链最长,侧链最多
- 编号:按照最低系列原则编号
- 按格式写出名称:立体化学名(顺反,ZE,cis-/trans-)+取代基名+主碳链数+母体名
2.5.1 单环脂环烃命名
就是在直链的基础上加一个“环”即可,比如环丙烷,环己烷。
2.5.2 含侧链的单环脂环烃
对于单取代,则环作为取代基进行命名,与前文直链命名相似,将环烃作为一种特殊取代基看待。
对于多取代,在以环烃为母体,在环上编号,按照前文对取代基的比较顺序,由大到小,使得编号位次尽可能低。
2.5.3 环烯/炔烃
命名原则:
+ 重键位次(组)最低,通常规定为1。 + 重键的两个碳原子编号必须连续 + 取代基位次(组)最低 + 按照前文规定排序
举例如下:
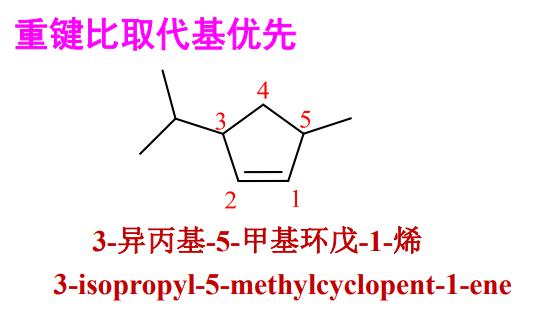
2.5.4 顺反异构——构型
类似于烯烃,环烃的特殊环结构限制了其单键的旋转,导致其同样会产生相应的顺反异构。
在环烃中,若取代基/官能团在环的同侧为顺,在异侧为反,具体说明如下图:
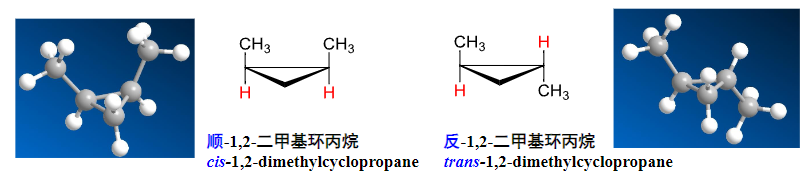
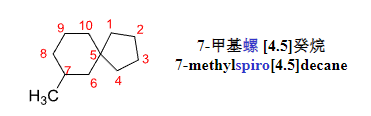
2.5.5 螺环化合物
螺环化合物:
两个环共用一个原子相连的化合物,被称为一螺化合物
编号原则:
- 编号从临近螺原子的碳原子开始,先小环后大环
- 重键位次最低
- 取代基位次最低
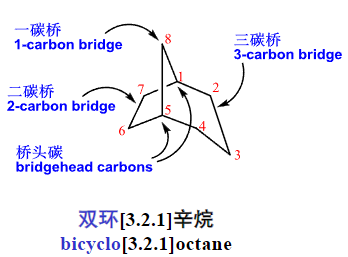
2.5.6 桥环化合物
桥环化合物:
一种特殊的环状化合物,其中含有至少两个碳原子(称为桥头碳)通过两个或两个以上的碳链(称为桥)相连。由于这种跨环连接的存在,形成了多个环系统。
桥环化合物的组成:
- 主环:包含桥头碳的最大环
- 桥:连接主环上两个非相邻碳原子的碳链
- 桥头碳:被桥连接的两个碳原子
- 桥位碳:组成桥的碳原子
编号原则:
- 编号从桥头碳开始,长桥->中桥->短桥
- 重键位次最低
- 取代基位次最低
2.6 脂肪烃和脂环烃的结构与稳定性
从标题中已经阐明了本节所遵循的两条主线,一个是结构,一个是稳定性,而研究后者就离不开对前者的探究,想要知道有机物的结构就必须知道其的立体结构。
2.6.1 烯烃的稳定性
先举出三种不同的烯烃和其的氢化能:
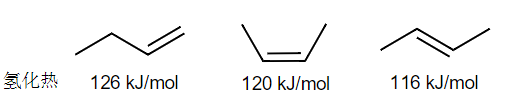
从上我们可以看出:中间烯烃比末端烯烃稳定,反式比顺式稳定。
第一点是为什么?为了解释这个,我们必须事先引入超共轭效应的概念。
超共轭效应:
碳-碳单键或碳-氢单键中的σ轨道电子与相邻的p轨道或π轨道发生部分重叠,从而产生电子离域的现象。这种离域效应使分子获得额外的稳定性。具体表现为:
- σ轨道(供体)→p或π轨道(受体)的电子转移
- 烯丙位的C-H键向邻近的空p轨道或π*轨道提供电子
- 超共轭效应的强弱顺序:3°C > 2°C > 1°C
至于反式构型为什么更稳定,可以从其结构更加接近直链的角度来解释。
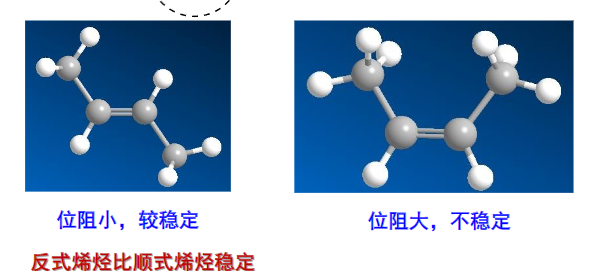
可以看到,反式构型的空间位阻小于顺式构型,更稳定。
同时,如果分子中的双键之间形成了共轭二烯等共轭结构,烯烃的稳定性也会得到提升。
值得注意的是,如果两个双键连同一个碳,这被称为累积二烯
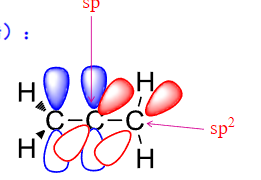
这不是那么稳定,但是也可以存在。
2.7 烷烃的构象
2.7.1 乙烷的构象
我们从简单的乙烷入手,看看非键合原子之间的排布是如何影响分子的稳定性的。
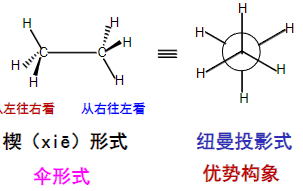
\({\sigma}\)键可轻松绕轴旋转,从而形成重叠式构象和交叉式结构。
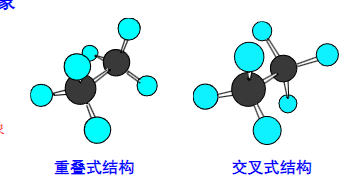
如何在纸面上表示出这两种结构呢?
一种是使用楔形来表示键的内外关系,一个是使用纽曼投影式。
纽曼投影式:
值得注意的是,这种现象既可以从成键原子轨道的相互排斥作用,也可以从成键轨道和反键轨道相互作用来解释,如下图:
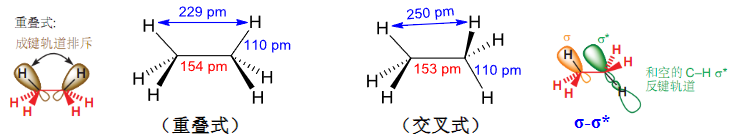
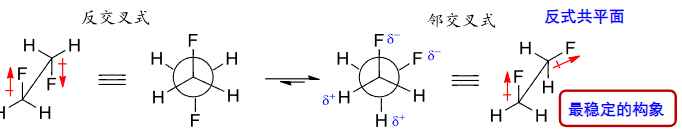
这里我们再来讨论更复杂的情况,比如1,2-二氟乙烷和1,2-二氯乙烷。
超共轭效应的具体例子:
由上图:对于1,2-二氟乙烷来说,其稍微错开反而比完全相反更加稳定,因为C-F键和C-H的反键轨道轨道作用形成的\({\sigma-\sigma^*}\)超共轭效应导致的。
对于1,2-二氯乙烷来说,其由于周期不同,超共轭效应减弱,偶极排斥作用占据主导作用,所以其完全错开的反交叉式更加稳定。
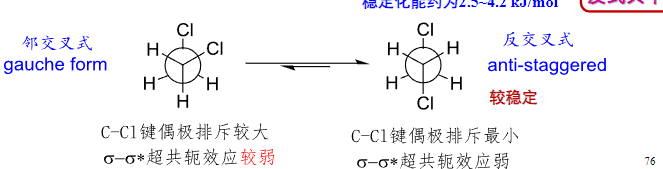
2.7.3 丁烷的构象
对于丁烷来说,其稳定构象更符合我们的直觉,反交叉式的构象是最稳定的。
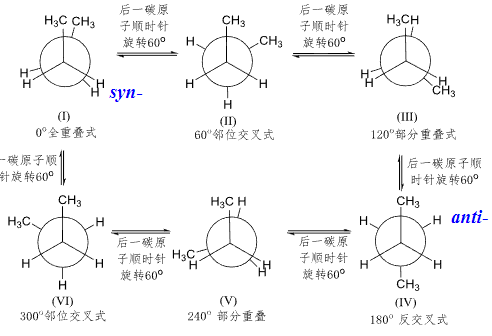
就上图概括来说,大基团之间越远越稳定。
2.7.4 环己烷的构象
在环己烷中,存在两种构象:椅式构象和船式构象,前者比后者更稳定(相互错开)
对于环己烷的椅式构型,其碳上的氢分为两类:
平伏键:
平行于环的中心平面的C-H键,又叫赤道键(e),其空间位阻大一些。
平伏基团易于发生1,3-二轴相互作用。直立键:
垂直于环平面的C-H键,又叫轴向键(a)。
直立基团易于发生1,3-二轴相互作用,空间位阻大。
对于单取代环己烷来说,其取代基团倾向于e键取代。随着基团的增大,取代平伏键的占比也上升。
对于多取代来说,大基团更倾向于占据e键,同时越多的取代基在平伏键上,分子越稳定。
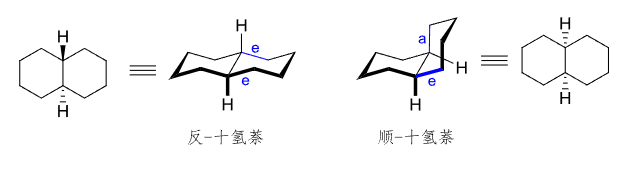
下简单举一例子来补充多环之间的顺反关系:
环间顺反异构:
十氢萘(系统名:双环[4,4,0]癸烷) 由上图,多环间的顺反判断同单环相似,最重要的依据是环连接处两个氢原子的朝向,同时我们默认了环采取椅式构象,因此可确定环的形状与朝向。
2.6 有机化学中的酸碱概念
2.6.1 布朗斯特酸碱
布朗斯特酸碱概念
- 酸是能给出质子的物质
- 碱是能接受质子的物质
- 酸碱反应是酸转移质子给碱的过程
- 酸给出质子后变为碱,称为该酸的共轭碱
- 碱接受质子后变为酸,称为该碱的共轭酸
这里我们举出一个很常见的例子:水
又有:
所以水可作酸,可作碱,在有机化学里,我们特别强调其的酸性(因为通常作为溶剂其浓度够高)
上面我们采用了\({K_a}\)来衡量酸碱反应的进行程度,如果我们采用水为参比碱,由此衡量出的\({K_a}\)可以用来比较不同物质之间酸碱的强弱关系。
以水为参比碱时,我们有:
通过比较酸性强弱,我们可以知道有机反应的进程,由高中已经了解过的化学反应平衡原理:
2.6.2 布朗斯特酸碱特征
布朗斯特酸碱有如下两特征:
- 酸性越强,其共轭碱的碱性越弱(反之亦然)
- 酸的共轭碱越稳定,其酸性越强(反之亦然)
其中第一个和第二个性质本质上是一回事,可以采用之前就学过的诱导效应,共轭效应来分析,化合物上电荷越分散越稳定,得到/失去质子后得到的一个电荷如果能通过共轭效应分散或者诱导效应稳定,就可以大大提高该化合物的碱性/酸性。
2.6.3 烃的酸性
从布朗斯特酸碱出发,影响烃的酸性的因素有以下:
- 元素电负性
- 碳原子相同杂化下,s轨道占据越多酸性越强
- 芳香性可以大大增强稳定性

2.6.4 路易斯酸碱
路易斯酸碱概念
- 酸是能接受电子对的物质
- 碱是能给出电子对的物质
- 酸碱反应是碱给出电子对给酸的过程
- 路易斯酸一般是具有空轨道的物质
- 路易斯碱一般是具有孤对电子的物质
路易斯酸碱的概念比布朗斯特酸碱更加广泛,能够解释更多的反应。例如:
其中\(\ce{BF3}\)是路易斯酸,\(\ce{NH3}\)是路易斯碱。
2.6.5 亲电性和亲核性
从前文路易斯酸碱理论,我们将酸碱的概念进一步扩大,只要能给出电子的就称为路易斯碱,能接受电子的就被称为路易斯酸。
在这里我们再次将酸碱联系到了我们已经学过的知识,什么样的化合物倾向于给出电子/接收电子?
当然是电子富裕/缺乏的啦!
由此我们延伸出了亲电试剂(缺乏电子,路易斯酸)和亲核试剂(富裕电子,路易斯碱)。
- 亲电试剂:与高电负性原子成双键(羰基),或与负电性原子连接(氯化氢)。
亲电试剂的较低能空轨道可以接收电子,如下: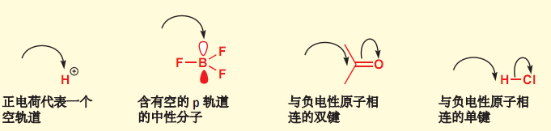
- 亲核试剂:有孤对电子的,四周有推电子基的。
亲核试剂从可用高能轨道贡献电子: