第九章 醇酚醚
9.1 醇、酚和醚的结构与命名
9.2 醇、酚和醚的物理性质
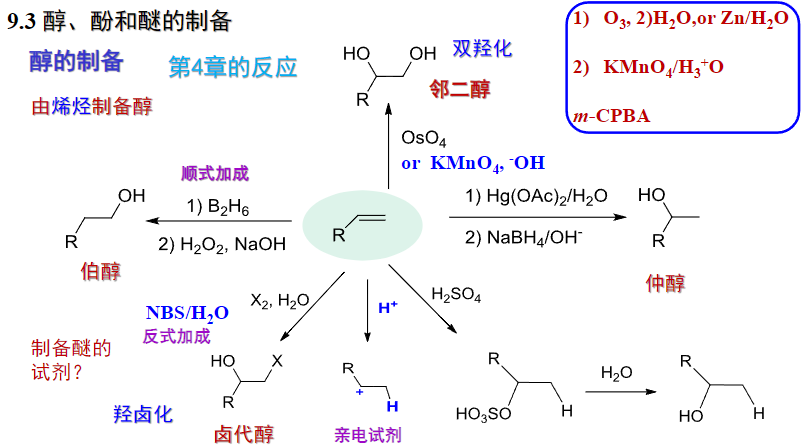
9.3 醇、酚和醚的制备
9.3.1 醇的制备
9.3.1.1 由烯烃制备醇
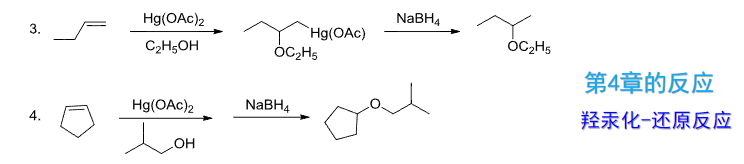
这部分主要涉及到第四章的反应。
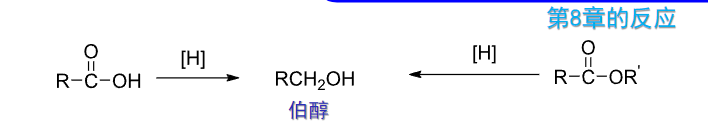
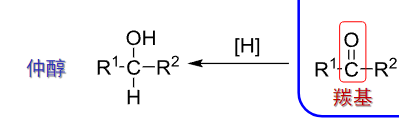
9.3.1.2 由碳基化合物制备醇
回顾上一章,可以用格式试剂:
这个反应生成叔醇。
同样还有:
还可以由环氧化合物制备醇,增长碳链:
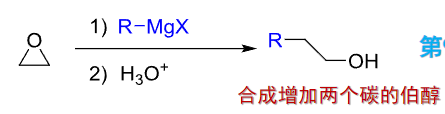
9.3.2 酚的制备
第一种是碱熔法:
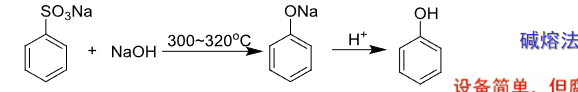
还可以通过芳香亲核取代进行水解:
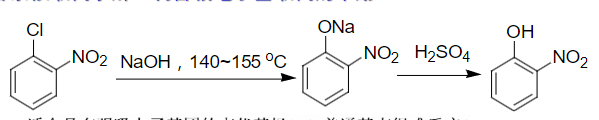
特别地,这个反应适合具有强吸电子基团的卤代芳烃。
还可以通过异丙苯氧化重排法:
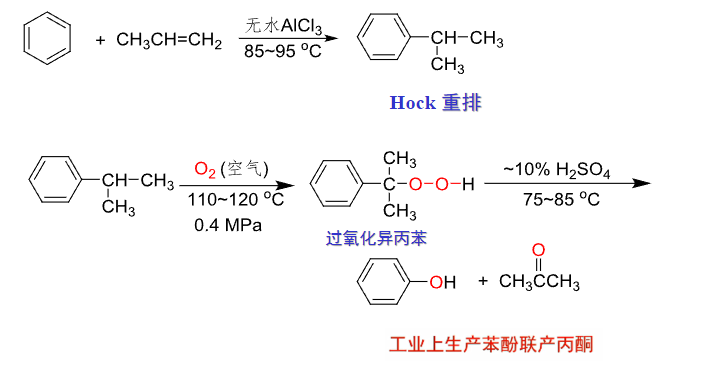
Hock重排反应:
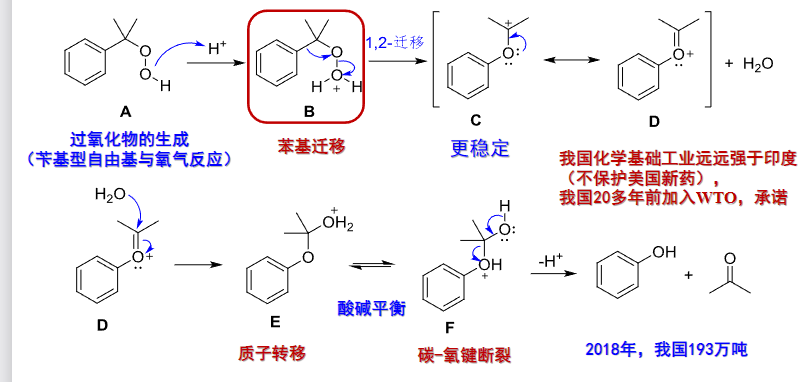
9.3.3 醚的制备
9.3.3.1 由醇制备醚
第一种是醇脱水缩合:
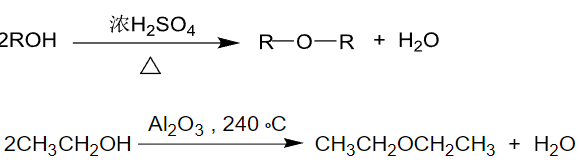
脱水剂一般采用的是硫酸(容易重排),氧化铝(温度高,重复使用,少重排)
9.3.3.2 Williamson合成法
第二种是Williamson合成法:

也是第八章中介绍过的醇钠与卤代烃的\(S_N2\)反应。
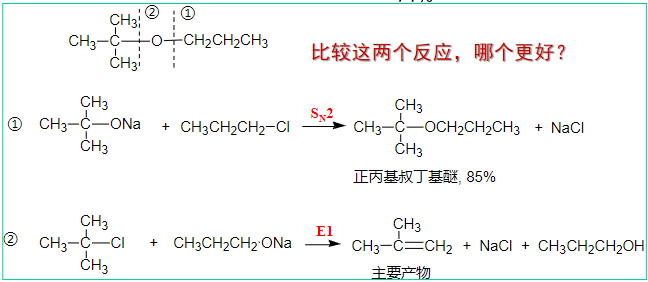
当然这个合成反应也要考虑到取代和消除反应的竞争问题,进行亲核进攻的基团尽量要小。
反应底物得当,还可以生成环醚:
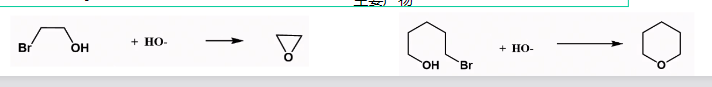
羟汞化还原反应也可以:
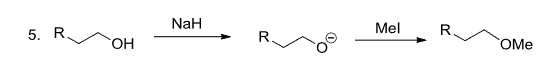
还可以通过\(\ce{NaH}\)作为强碱进行反应:
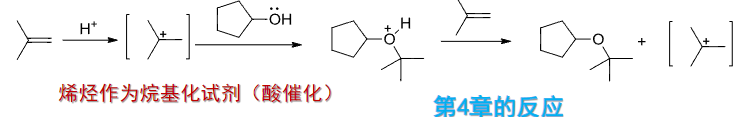
可以从烯烃作为烷基化试剂的角度出发:
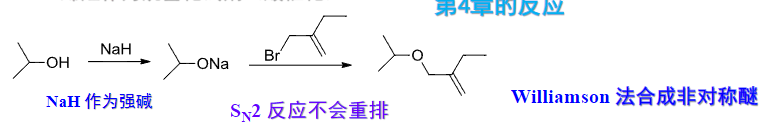
特别的,制备芳醚时应采用酚钠与伯卤代烷反应:
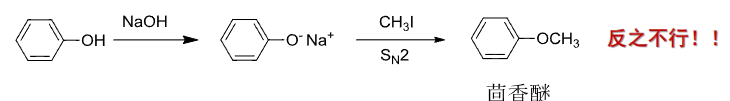
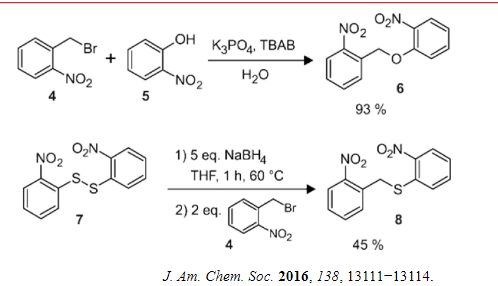
9.3.4 Ulmann缩合
Ulmann缩合是金属参与的有机反应,在\(\ce{CU、Pd}\)等过渡金属的催化下制备芳基醚。
9.4 醇、酚和醚的酸性和碱性
对于一个醇来说,针对羟基这个官能团可能带来的反应有如下几种情况:
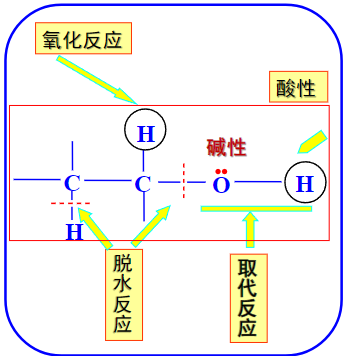
我们可以发现,在上图中共同出现了代表酸性和碱性的反应。
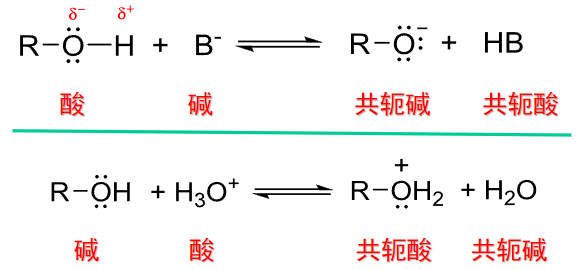
在与不同酸/碱反应的条件下,醇就有可能表现出不同的性质。实际上,酸碱是相对的。
9.4.1 醇和酚的酸性
首先,pKa是酸电离常数的负对数,是常用的衡量化合物酸性大小的值。pKa越小,酸性越强。
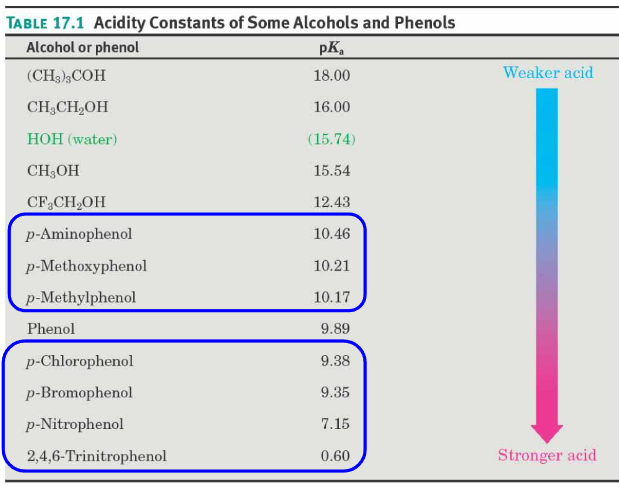
由于羟基和酚羟基的酸性和\(\ce{O-H}\)的极性大小有关,\(\ce{O-H}\)的极性越大,酸性越强。
同时,如果给出质子后生成的共轭碱越稳定,那么化合物的酸性越强。
就此我们可以对一个醇/酚的酸性进行初步的判断:

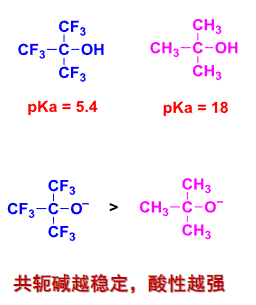
考虑立体效应与溶剂化作用:
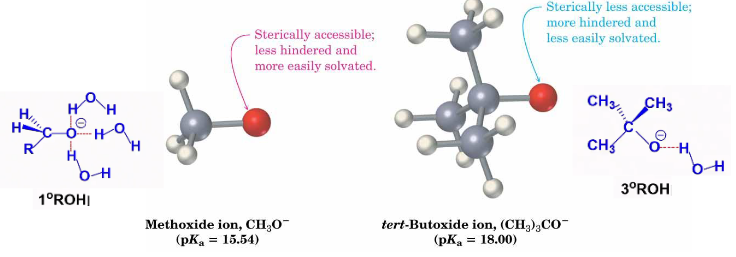
α-碳支链越多,共轭碱体积越大,溶剂化作用越弱,稳定性越小,酸性越弱。
酚的酸性为什么比醇强?我们要考虑碳的杂化,早在第二章我们就讨论过不同杂化的碳之间的吸电子能力对比。
同时芳环提供了一个很好的共轭环境,用来稳定\(\ce{H+}\)离去后\(\ce{O-}\)上的负电荷。
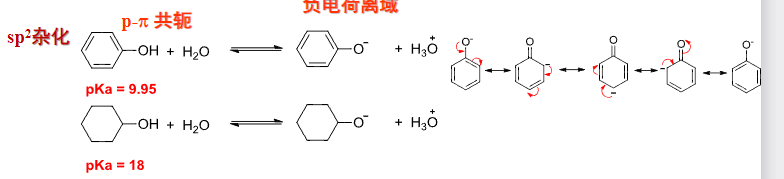
所以我们判断醇/酚的酸性,需要综合考虑共轭效应与诱导效应的影响:
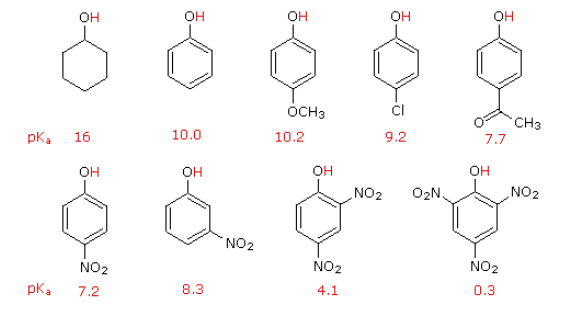
总体上,吸电子效应越强,醇/酚的酸性越强。
特别的,邻位取代时通常由于位阻原因不能共平面而导致共轭效应显著降低:
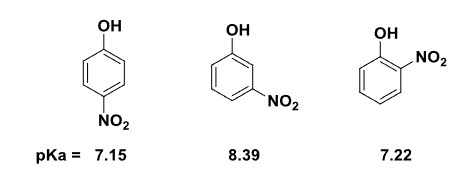
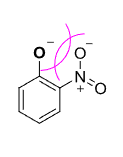
总结如下:

9.4.2 醇、酚和醚的酸性和碱性
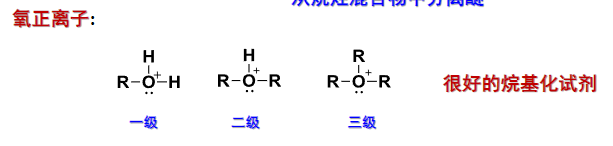
在强酸参与反应的条件上,羟基的氧上带有的孤对电子也可以使醇/酚/醚呈现碱性。
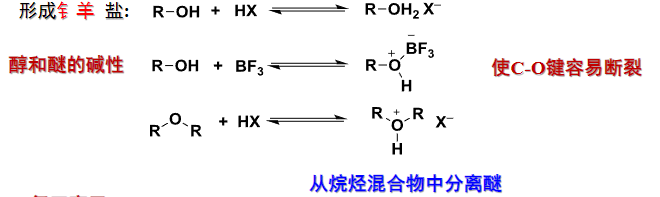
以上反应都会生成氧正离子,是很好的烷基化试剂。
醚的酸性展示如下:
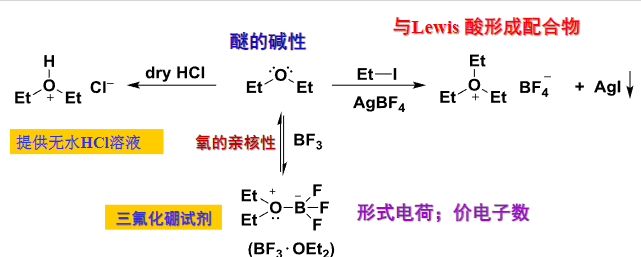
醚的碱性使得其成为很好的配位体来稳定别的化合物:

酚类化合物是一种烯醇式结构,遇到三氯化铁溶液也发生颜色反应:
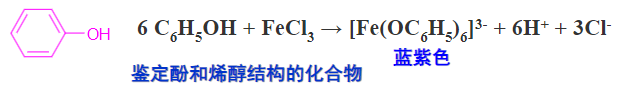
这是一个很经典的坚定酚和烯醇结构存在的反应。
下面这个反应展示了醇的碱性:
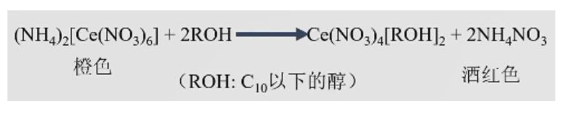
9.5 醇、酚和醚的反应
以下的讨论都是围绕着与官能团相关的化学键是如何断裂和再形成的,我们仅以醇举例来展示大概的思路:
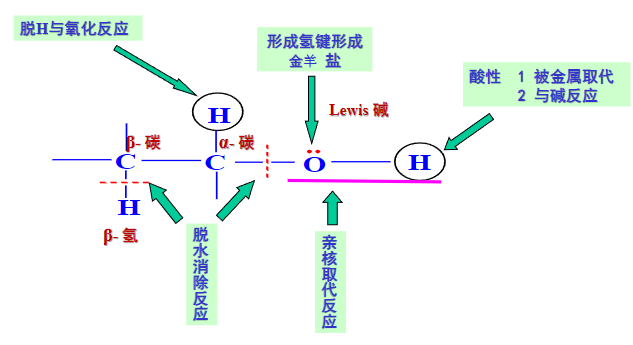
9.5.1 醇的酯化反应
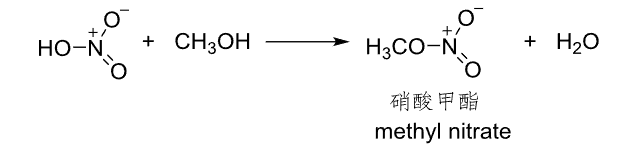
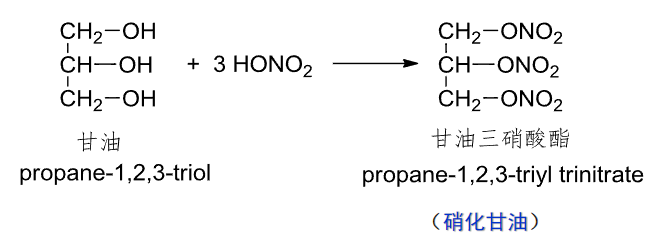
9.5.1.1 与硝酸反应
醇与硝酸反应,生成硝酸酯。
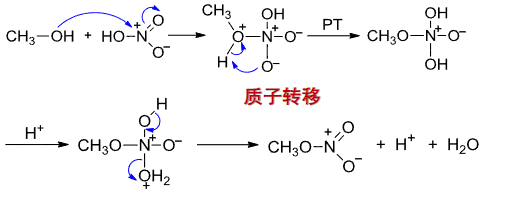
醇与硝酸的反应机理研究很少,一个可能的途径如下(仅做了解):
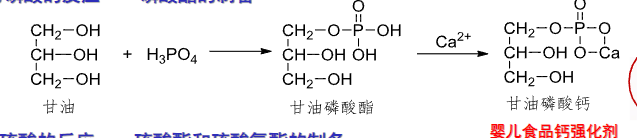
9.5.1.2 与磷酸反应
醇与磷酸反应,生成磷酸酯。
9.5.1.3 与硫酸反应
醇与硫酸反应,生成硫酸酯和硫酸氢酯。
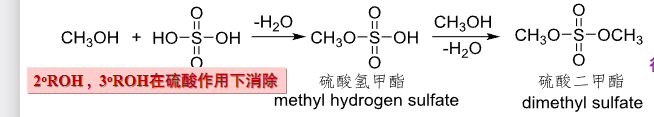
特别的,伯醇容易发生上述反应,如果是仲醇、叔醇,在硫酸催化下倾向于发生消去反应。
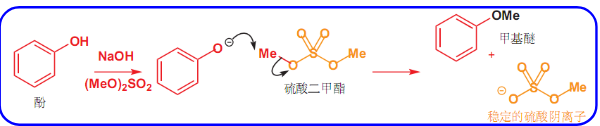
硫酸二甲酯是很好的甲基化试剂,应用如下:
9.5.1.4 与磺酰氯反应
醇可与对甲苯磺酰氯(TsCl)反应,通常作为使醇被亲核进攻的准备反应:

其中,\(\ce{-OTs}\)是很好的离去基团,变相提高了醇被亲核进攻的活性。
9.5.2 醇的亲核反应
9.5.2.1 与HX反应
醇和卤化氢反应生成卤代烃:
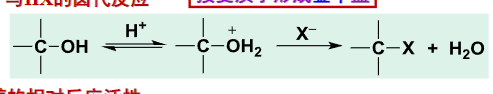
其相对反应活性如下:

卤化氢相对反应活性:

由于反应活性的降低,相同醇不同卤化氢的取代反应的条件也不同:
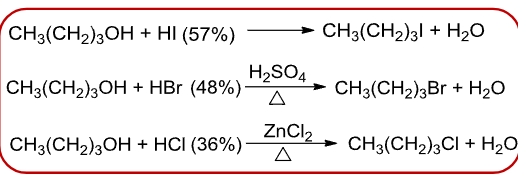
其反应机理如下:
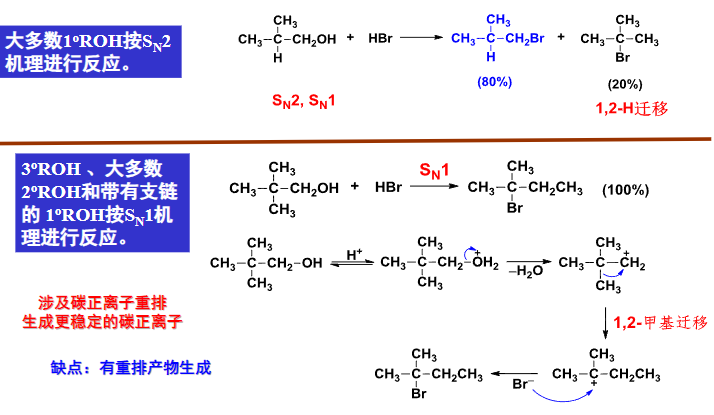
9.5.2.2 与Lucas试剂反应
用Lucas试剂可以鉴别六碳以下的一级、二级和三级醇与苄醇,这个反应是典型的\(S_N1\)反应。
Lucas试剂
浓盐酸和无水氯化锌的混合物。
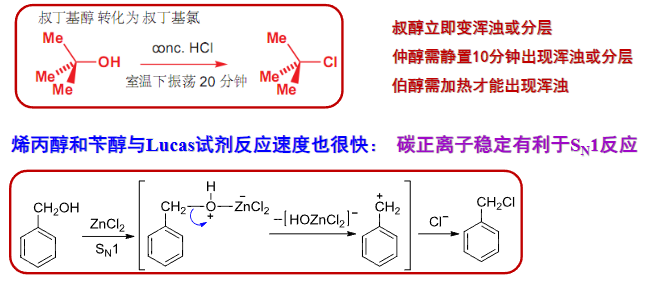
为什么要求六碳以下?因为超过这个碳数的醇不溶于水。
9.5.2.3 与卤化磷反应
醇与卤化磷的反应是制备卤化烃的重要反应。
在这种卤代反应中,常用的卤化试剂有:\(\ce{PCl5、PCl3、PBr3、PI3}\)
主要适用于伯醇和仲醇的卤代反应。
机理如下:
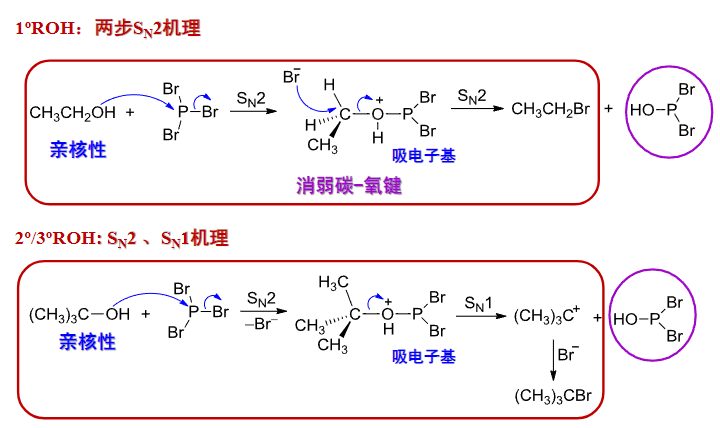
特别注意到,不同的醇之间遵循的反应路径是不同的。
9.5.2.3 与氯化亚砜反应
醇与氯化亚砜的氯代反应也是常见的卤代烃制备方法。
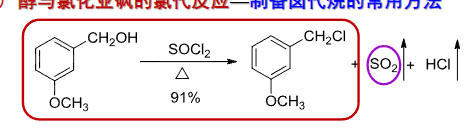
机理如下:
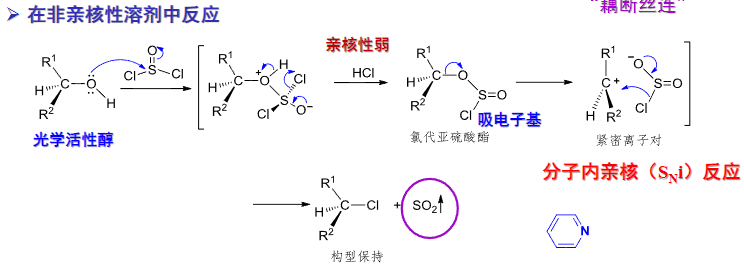
9.5.3 醇的消除反应
醇的消除反应就是脱水反应,一般在亲核能力弱的质子酸催化下发生。
分子间反应,生成醚:
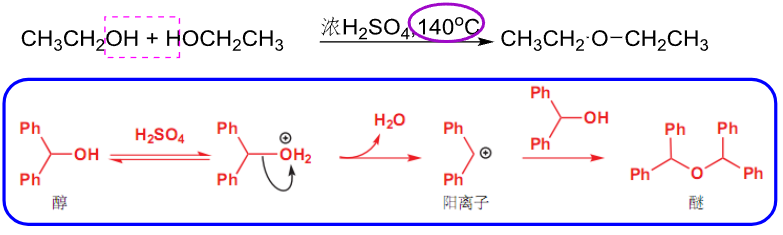
分子内反应,生成烯烃:
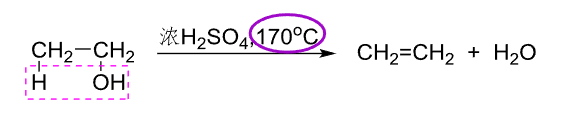
一般来说,低温下醇分子间脱水生成醚,高温下醇分子内脱水生成烯。
对于分子内反应,一般遵循E1消除机理,生成更稳定的产物:
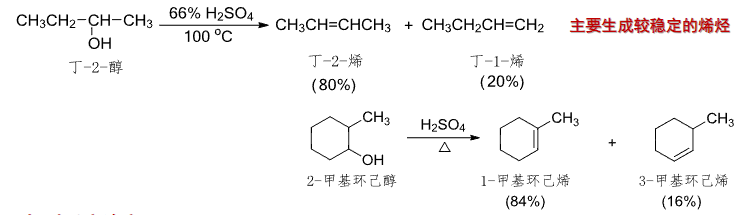
所以支链越多,反应越快。
反应机理如下:
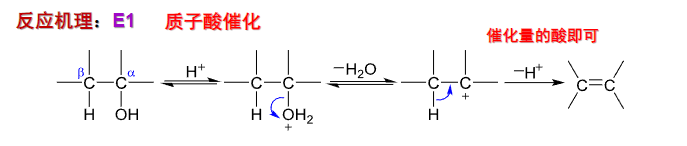
一般不用HX作为酸催化剂(亲核取代反应与消除反应竞争)。
基本的机理展示如下:
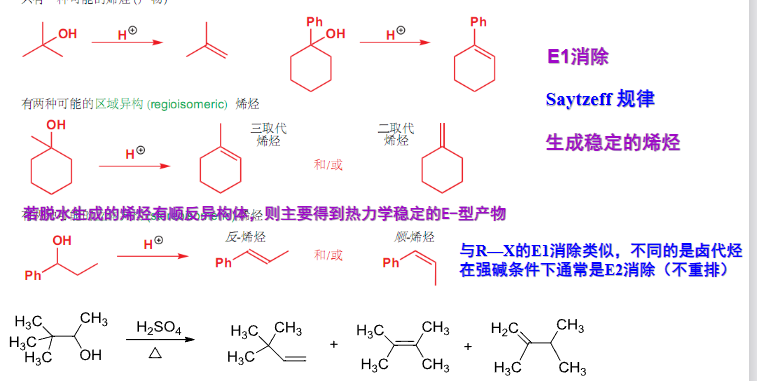
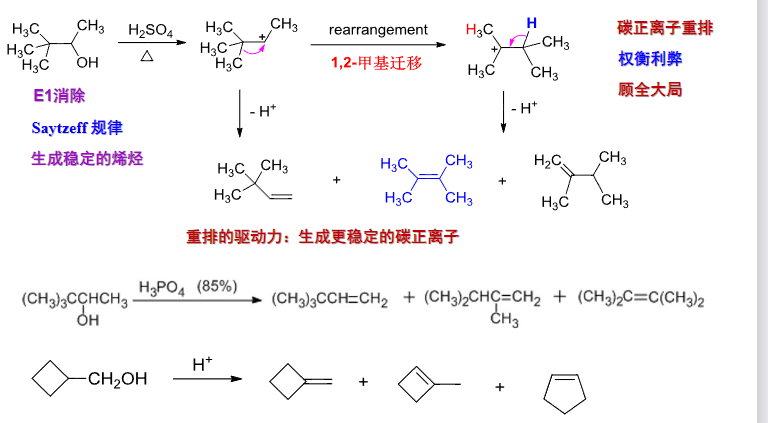
这里额外总结一下,已经接触到的,会产生碳正离子中间体的反应:
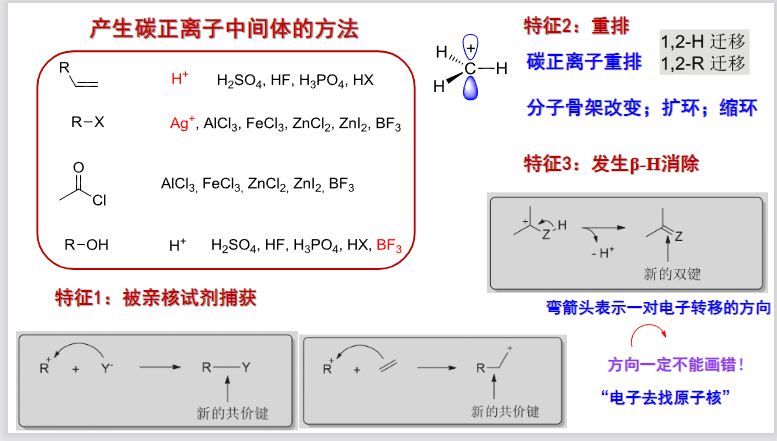
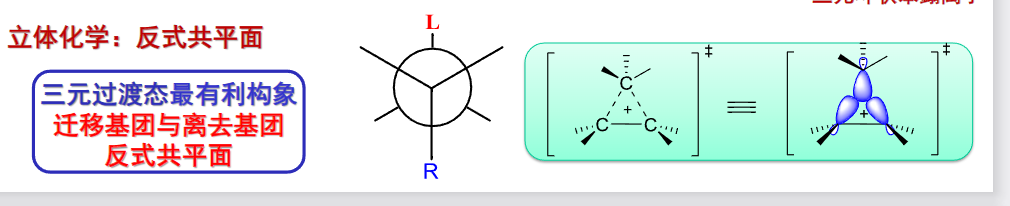
9.5.4 邻二醇重排反应
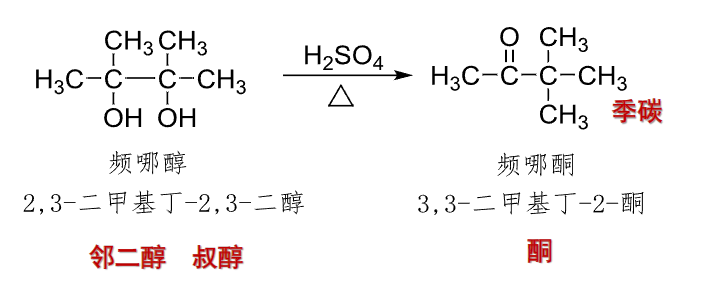
对于烃上并排的两个羟基来说,在\(\ce{H2SO4}\)存在的条件下,加热可发生邻二醇重排反应——pinacol重排:
其机理如下:
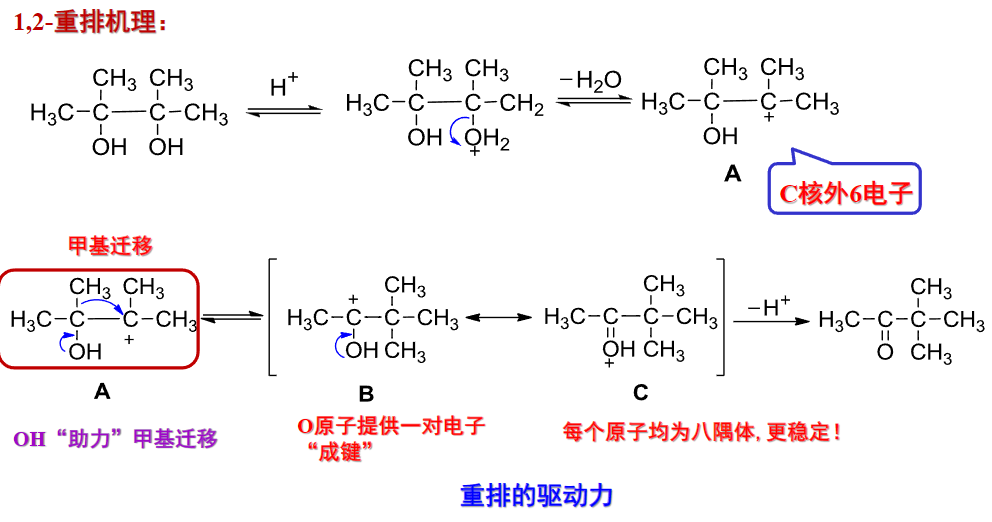
过程中发生了碳正离子的重排——为了形成更稳定的中间体。
以上的反应讨论的主要是对称邻二醇,所以两个羟基的行为本质上没有先后之分。
如果有一个非对称邻二醇,哪个羟基先接受质子先离去呢?
自然是考虑我们已经讲了无数遍的中间产物的稳定性——哪个羟基离去后碳正离子最稳定,哪个羟基先离去。
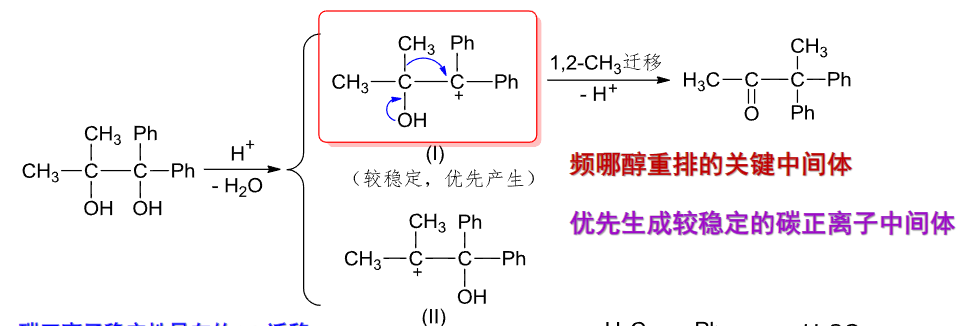
当然,如果羟基一侧的基团也各不相同,自然也会有谁先迁移的问题:
电子越富裕,越容易迁移,\(\ce{H}\)由于体积比较小,电子云是球形的,无方向性,最容易迁移。
芳香烃由于普遍富电子,比烷烃更容易迁移,在芳香烃之间也是越富有电子越容易迁移。
当然,我们也不能忽略立体化学上的构象选择,迁移基团与离去基团最好处在反式共平面的构象上:
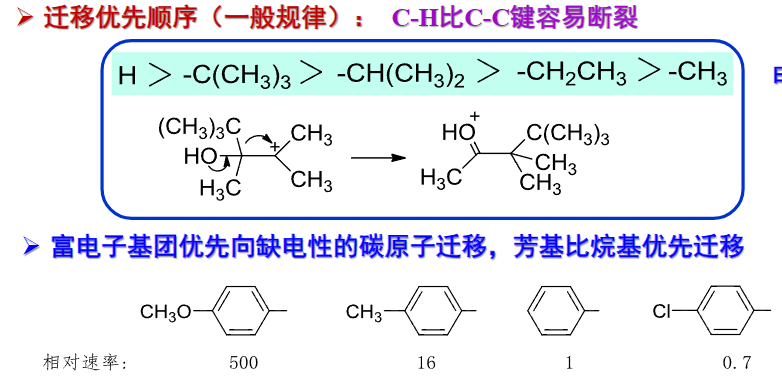
在环上发生的话,也要求在环上反式共平面:
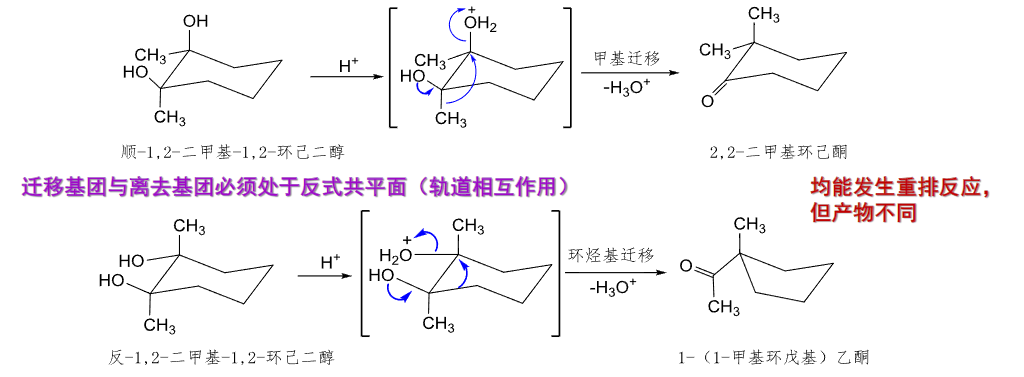
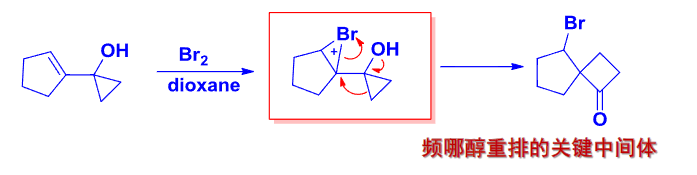
这里再介绍一个类Pinacol重排反应,与Pinacol重排不同的是其起始的化合不同,类Pinacol重排反应的起始化合物是环氧化合物,经过\(\beta\)-羟基碳正离子中间体的重排:
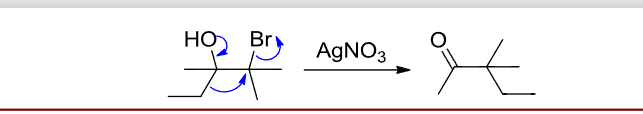
如果结合之前卤代烃与硝酸银的反应,可以补充一个重排反应:
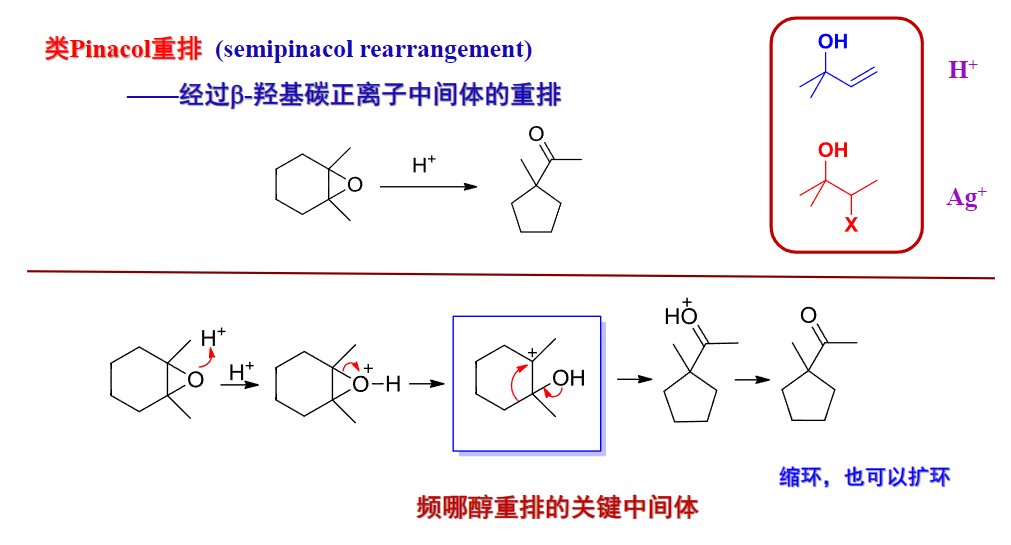
类似的还有半Pinacol醇重排:
9.5.5 醇和酚的氧化与脱氢
常见的醇的氧化路径如下:
常见的氧化剂如下:

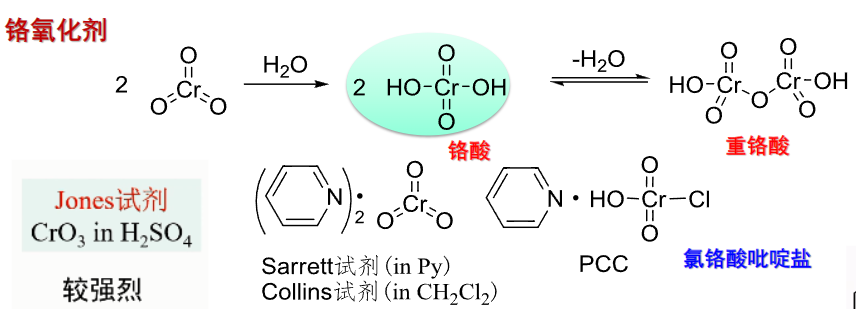
9.5.5.1 铬氧化剂
常见的铬氧化剂:
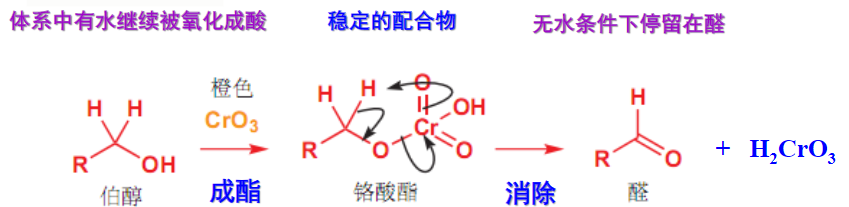
三氧化铬氧化醇,在无水情况下生成醛:
Jones试剂将伯醇氧化为羧酸,PCC将伯醇氧化为醛:
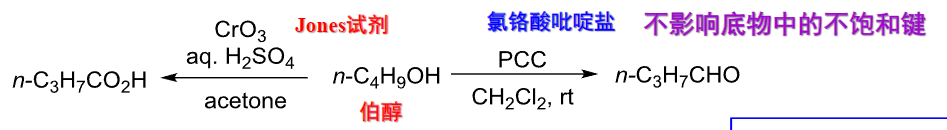
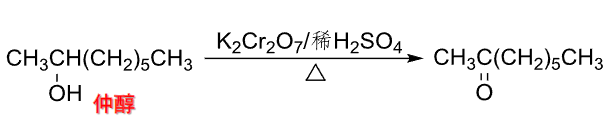
\(\ce{K2Cr2O7/稀H2SO4}\)将仲醇氧化为酮:
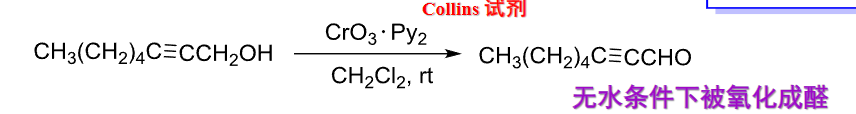
Collins试剂在无水条件下将醇氧化为醛:
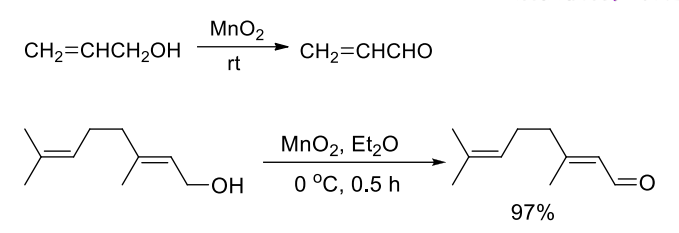
9.5.5.2 新制二氧化锰
新制二氧化锰活性较弱,选择性把烯丙型醇氧化为烯丙型醛。
9.5.5.3 Swern氧化
由\(\ce{DMSO}\)在\(\ce{Et3N}\)下,可将醇氧化为醛/酮、
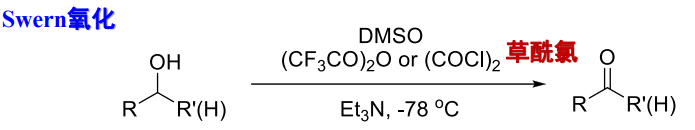
9.5.5.4 丙酮氧化脱氢——Oppenauer氧化
这种氧化反应选择性好,只涉及醇和酮之间的\(\ce{H}\)原子转移,如果没有催化剂,则反应不会发生!!
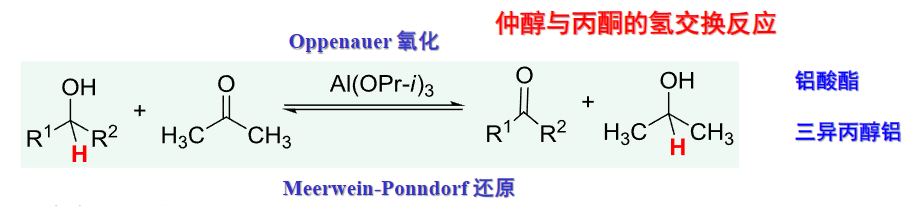
这个反应可逆向进行,丙酮过量则发生Oppenauer氧化,异丙醇过量则发生Meerwein-Ponndorf还原。
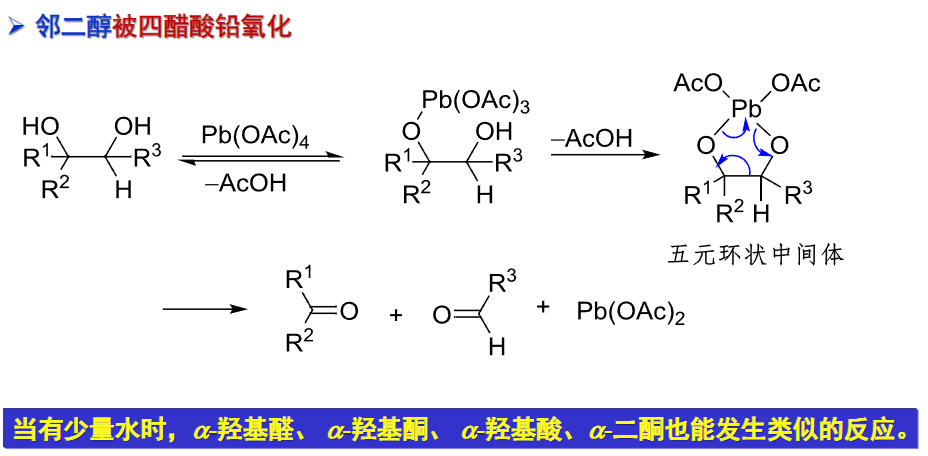
9.5.5.5 高碘酸和四醋酸铅氧化
邻二醇与高碘酸等氧化剂的反应是特殊的邻二醇氧化,氧化剂是\(\ce{H5IO6、KIO4、NaIO4}\)。
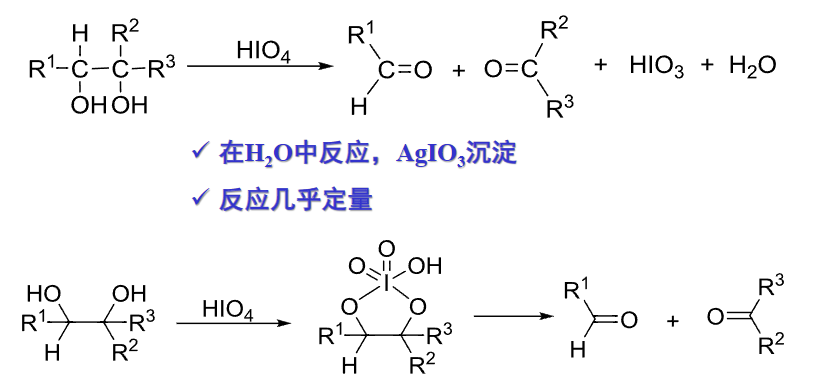
特别的,这个反应对邻二醇的构象有特殊要求:两个羟基要尽可能顺式共平面(可见上图第二个反应式)。
在环上的选择性更加明显:
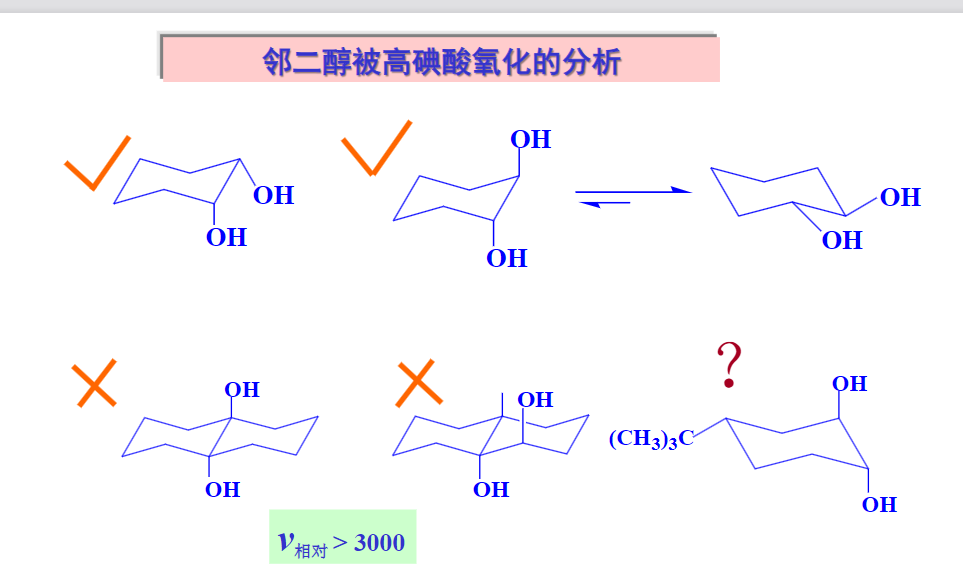
顺式共平面反应最容易发生,反式构象如果可以扭转,使其都在e键上,反应也可以发生,只不过会慢很多。
邻二醇与四醋酸铅的反应也是一种特殊的邻二醇氧化:
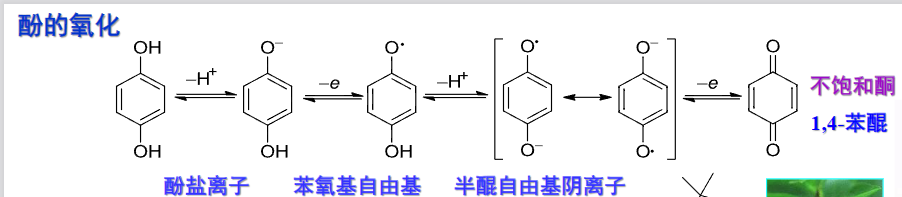
9.5.5.6 酚的氧化
9.5.6 酚的亲电取代反应
9.5.6.1 溴代反应
酚与溴的反应无需催化剂,在水溶液中即可反应:
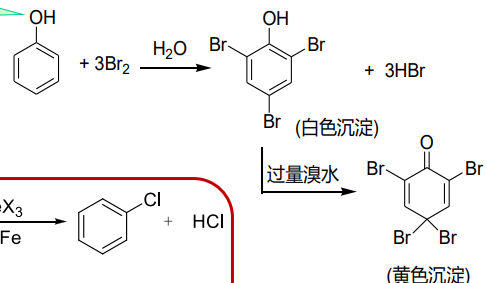
反应如此容易的原因是苯环上的羟基充当了亲电反应的活化基团。
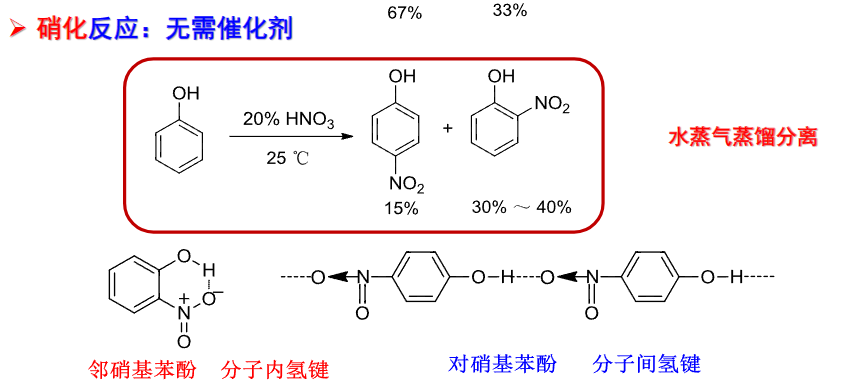
9.5.6.2 硝化反应
硝化反应与酚反应无需催化剂。
9.5.6.3 磺化反应
此事在芳香烃中亦有记载:
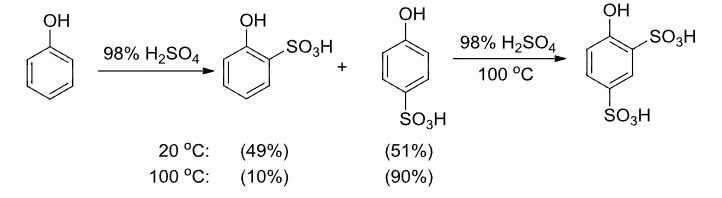
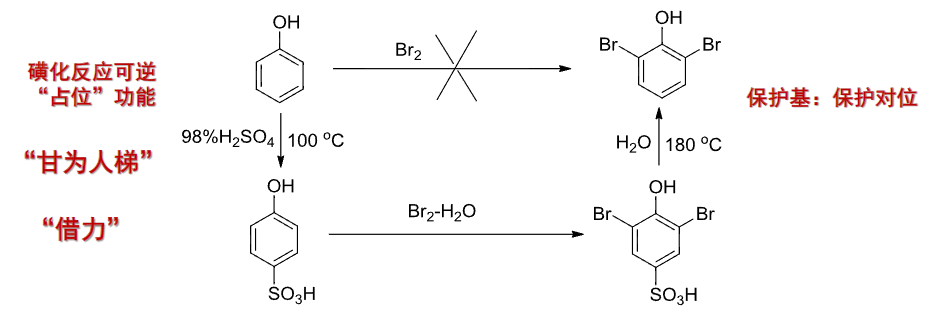
磺化反应可逆,可以占位或者帮助部分取代反应的发生:
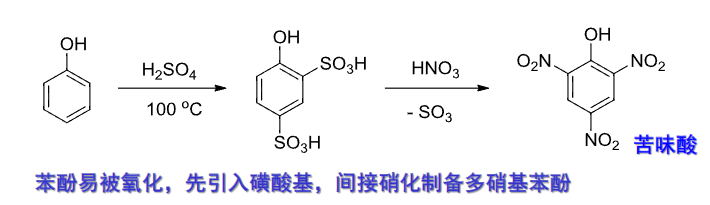
由于苯酚很容易被氧化,可以先引入磺酸基来间接制备多硝基苯酚:
9.5.6.4 Friedel-Crafts烷基化反应
与苯的反应不同,由于苯酚上的羟基容易先与用于催化的\(\ce{AlCl3}\)反应,且\(\ce{AlCl3}\)也不溶于常用有机溶剂:
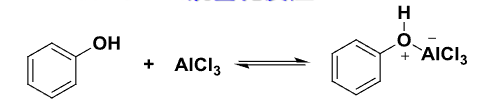
所以我们一般不同\(\ce{AlCl3}\)作为苯酚的Friedel-Crafts烷基化反应的催化剂。一般我们采取以下反应路径:
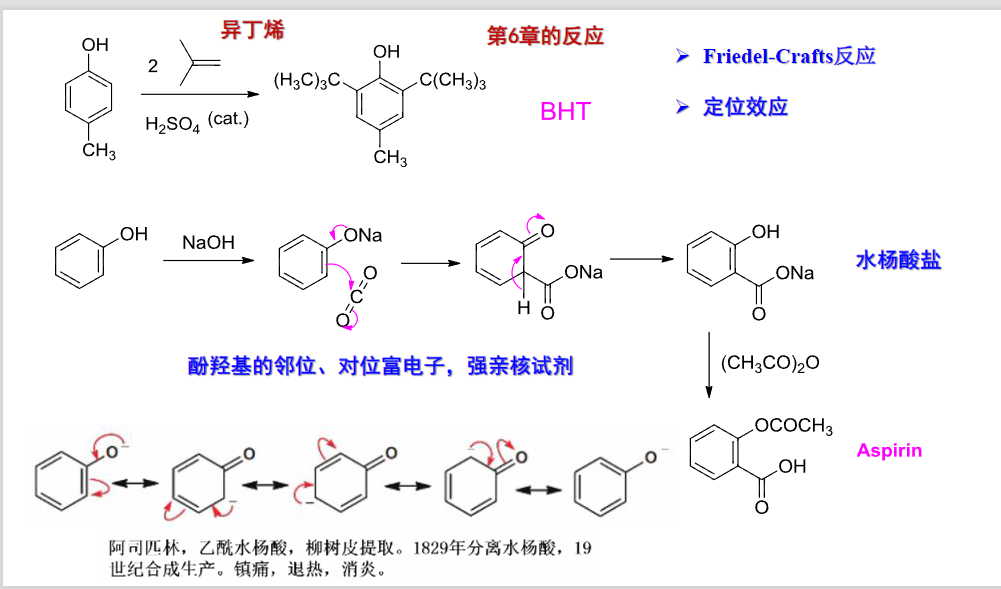
9.5.6.5 酚与醛酮的缩合
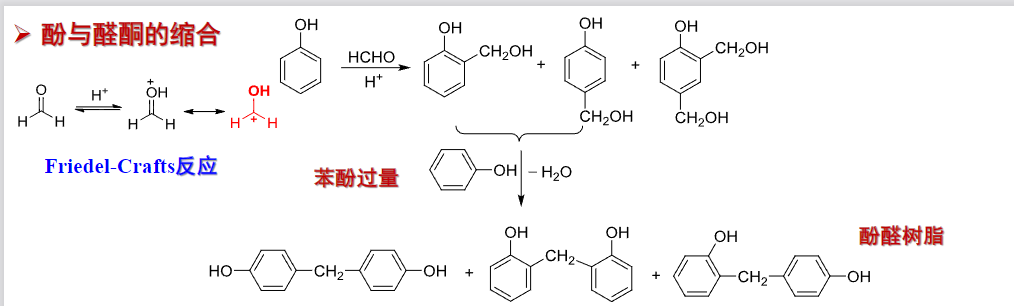
反应机理如下:
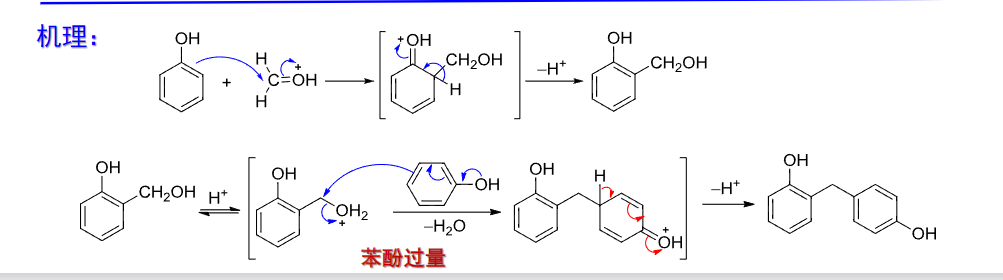
有更多应用如下:
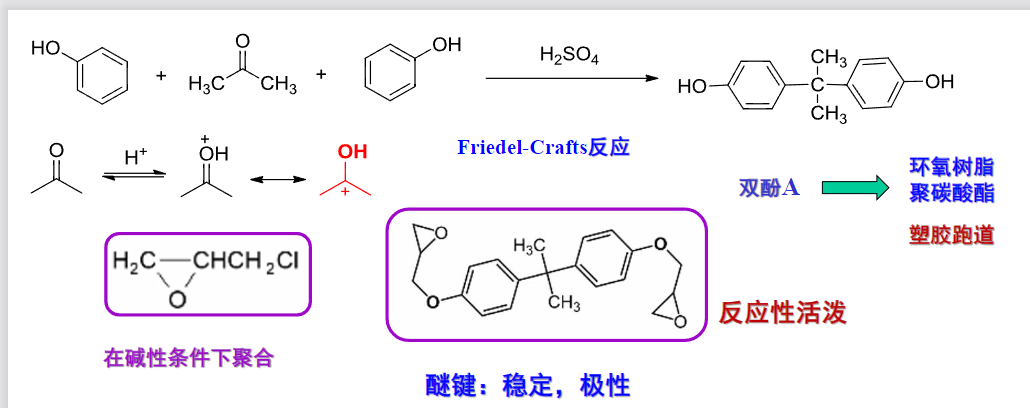
9.5.7 醚键断裂的反应
醚的稳定性仅次于烷烃,常温下一般不发生反应,所以其很适合用作溶剂。
9.5.7.1 醚的碳氧键断裂反应
醚做亲电试剂,可以被卤化氢或卤素亲核进攻——使氧带上正电。
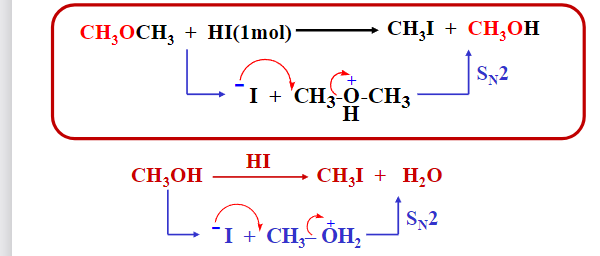
\(S_N2\)反应:
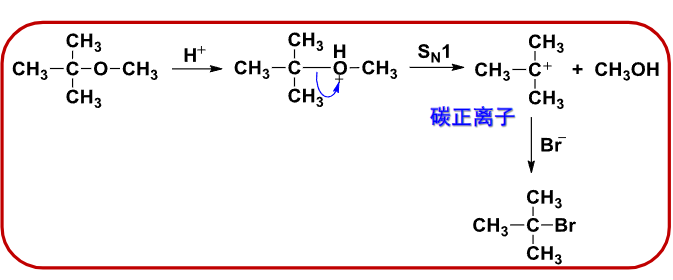
\(S_N1\)反应:
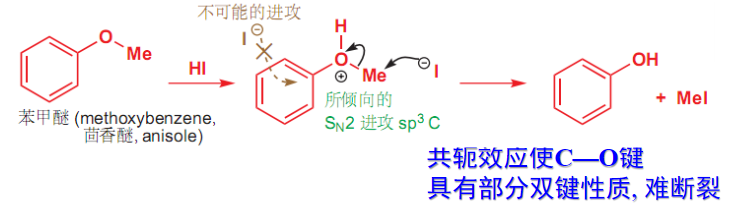
考虑到\(S_N2\)反应等机理的存在,立体化学上对亲核试剂的进攻方向有所要求:
一般规律如下:
- 卤化氢反应性能: \(\ce{HI>HBr>HCl(浓)}\)
- 碳氧键断裂顺序: 3°烷基>2°烷基>1°烷基>甲基>芳基
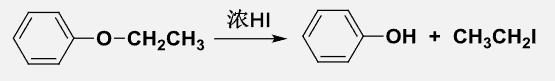
- 在浓HX作用下,芳醚断裂总是生成酚和卤代烃:
9.5.7.2 环醚的与氢碘酸开环反应
这部分在接下来的章节进行详细介绍,故此从略。
9.5.8 环氧化合物的开环反应
- 酸性条件下:质子化-亲和取代
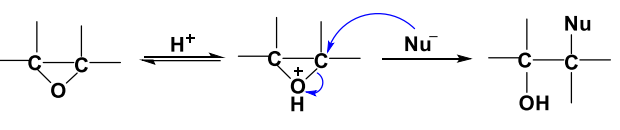
- 碱性条件下:亲核取代-质子化
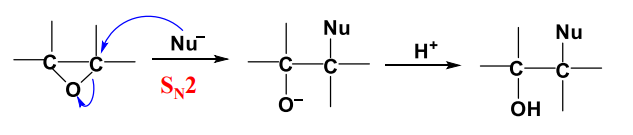
如果醚键两侧不对称,开环反应就具有区域选择性和立体选择性。
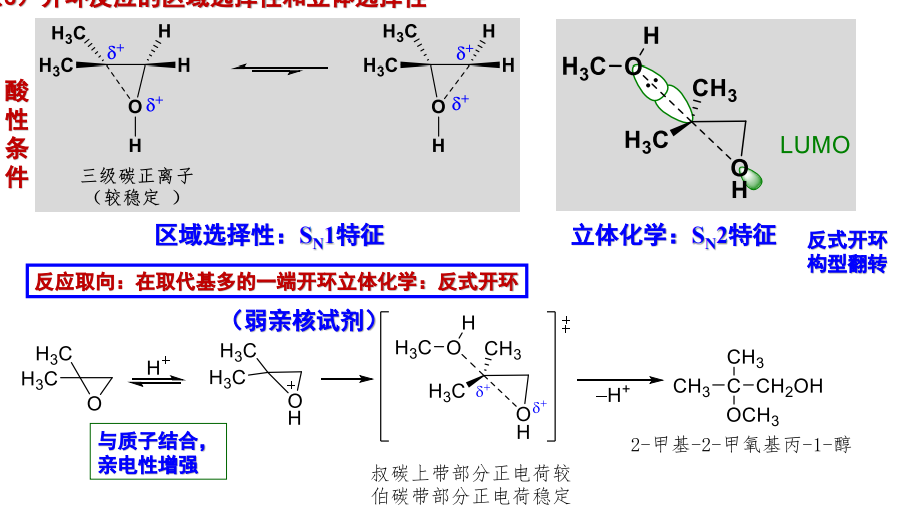
酸性条件下,取代基多的一端更容易开环,且立体取向为反式开环:
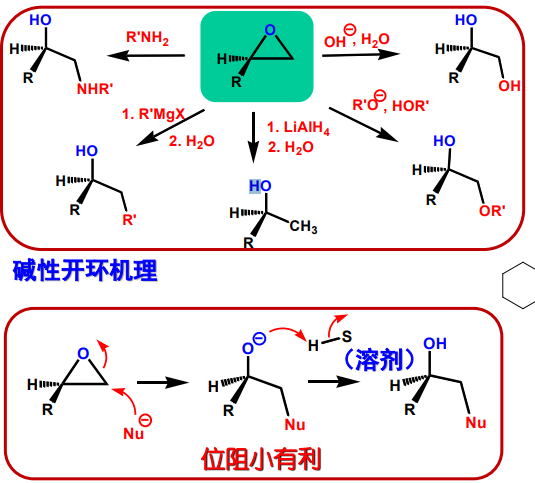
碱性条件下,取代基少的一端更容易开环,且立体取向为反式开环:
9.6 硫醇、硫醚和硫酚
常见的硫醇、硫醚和硫酚如下:
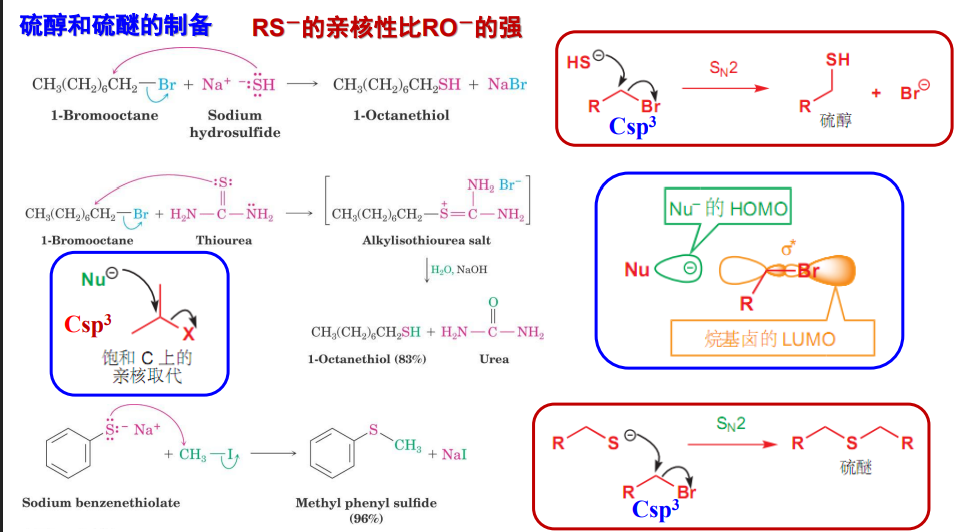
9.6.1 硫醇和硫醚的制备
一般采用卤代烃和有机硫化物反应: