第八章 卤代烃
8.4 卤代烷的亲核取代反应
卤代烷的亲核取代反应模板反应如下:
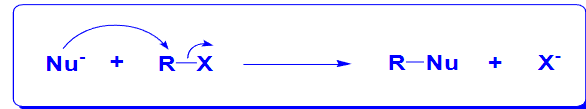
由于卤素的高电负性,使得其烷基上往往带有正电,促使亲核进攻的发生。
其中\(\ce{Nu-}\)为亲核试剂,常见的亲核试剂如下:

以下举出多种亲核取代反应\(S_N\)
8.4.1 亲和取代反应
8.4.1.1 水解反应
水解反应
- 亲核试剂:\(\ce{OH-}\)
- 产物:\(\ce{ROH}\)
反应实例如下: \(\(\ce{R-X + NaOH \xrightarrow{\ce{H2O}} ROH + NaX}\)\)
其的主要用途是通过引入卤素原子来制备一些难以直接合成的醇。
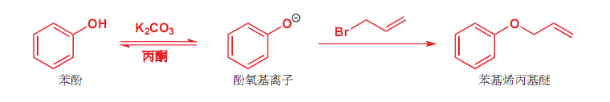
8.4.1.2 与醇钠或酚钠作用
醇钠/酚钠取代反应
- 亲核试剂:\(\ce{RO-H、PhO-H}\)
- 产物:\(\ce{R-O-R'}\)(不对称醚)
反应实例如下:
\[\ce{RX + R'ONa -> R-O-R' + NaX}\]
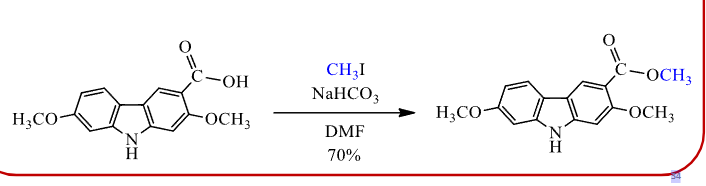
8.4.1.3 与羧酸根负离子反应合成酯
羧酸根取代
- 亲核试剂:\(\ce{RCOO-}\)
- 产物:\(\ce{R-COO-R'}\)
反应实例:
\[\ce{R-COO- Na+ + R-X -> RCOOR' + NaX}\]
8.4.1.4 与硝酸银反应生成硝酸酯
硝酸银取代反应
- 亲核试剂:\(\ce{NO3-}\)
- 产物:\(\ce{RONO2}\)
反应实例:
\[\ce{RX + AgNO3 \xrightarrow{醇} RONO2 +AgX\downarrow}\]
该反应是一个典型的\(S_N1\)反应(弱亲核试剂。

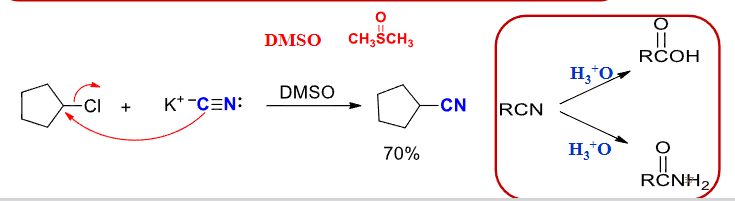
8.4.1.5 与氰化物作用
氰化物取代反应
- 亲核试剂:\(\ce{CN-}\)
- 产物:\(\ce{RCN}\)
反应实例:
\[\ce{RX + NaCN -> RCN + NaX}\]
二甲亚砜,化学式为\(\ce{CH3SO-CH3}\),DMSO。

以上取代反应得到的取代物还可以有更进一步的反应:
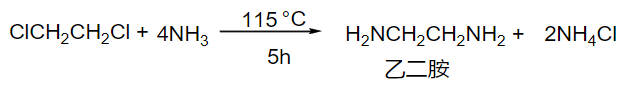
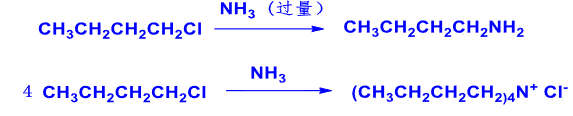
8.4.1.6 与氨和胺作用
氨/胺取代反应
- 亲核试剂:\(\ce{NH3}\)
- 产物:\(\ce{RNH2}\)(过量)、\(\ce{R3N+ X-}\)(少量)
反应实例:
\[\ce{RX + 2NH3 -> RNH2 + NH4X}\]
8.4.1.7 与叠氮化钠反应
叠氮化钠取代反应
- 亲核试剂:\(\ce{N3-}\)
- 产物:\(\ce{RN3}\)
反应实例:
\[\ce{RX + NaN3 -> RN3 + NaX}\]
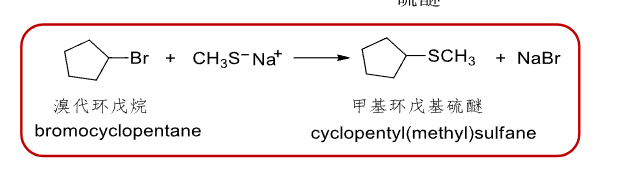
8.4.1.8 与NaSH和NaSR的反应
\(\ce{NaSH/NaSR}\)取代反应
- 亲核试剂:\(\ce{SH-、SR-}\)
- 产物:\(\ce{RSH、RSR'}\)
反应实例:
\[\ce{R-X + NaSH -> RSH + NaX}$$ $$\ce{R-X + NaSR' -> RSR' + NaX}\]可以分别生成硫醇或者硫醚。
补充一个反应:
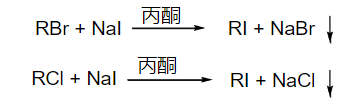
8.4.1.9 卤离子互换
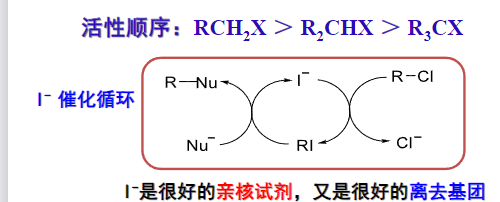
- 碘:半径大、电负性小、易极化
- 碘离子:很好的亲核试剂
- C-I键:易异裂,很好的离去基团
8.4.1.10 与碳负离子亲核试剂反应
烷基化反应
- 亲核试剂:\(\ce{R-C#CH-}\)
- 产物:\(\ce{R-C#C-R'}\)
反应实例:
\[\ce{R-X + RC#C- Na+ -> RC#CR' + NaX}\]
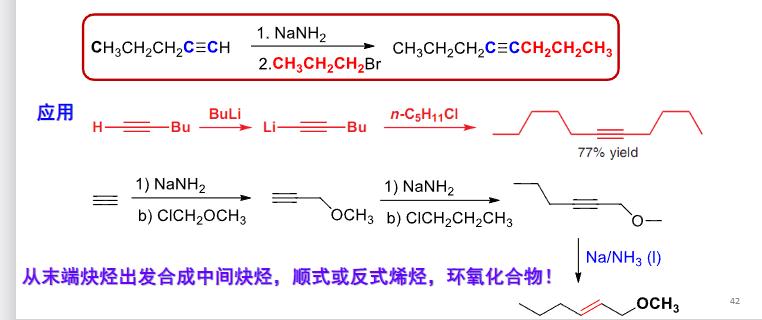
最后来几张图总结一下:
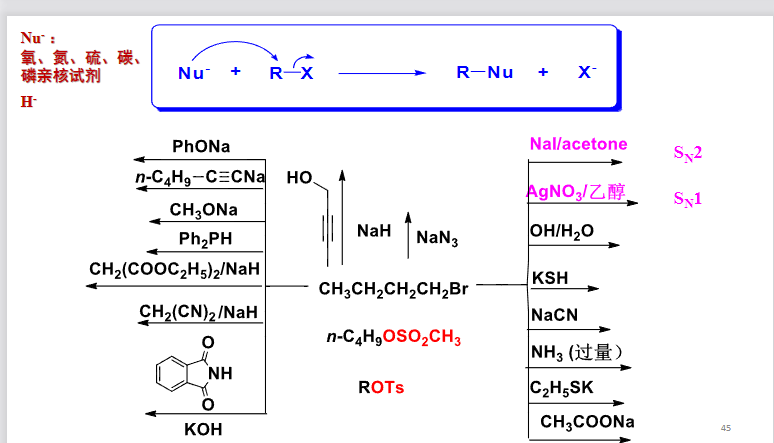
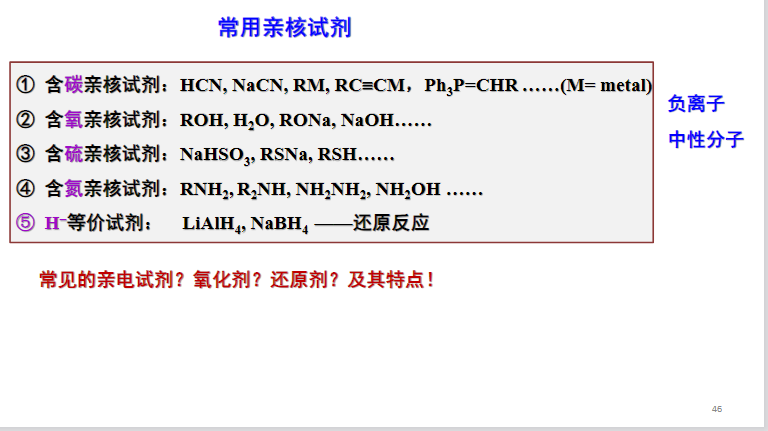
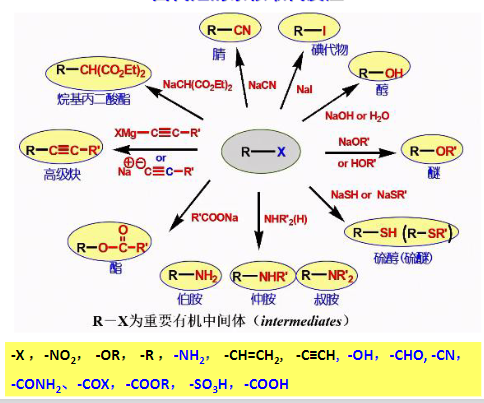
8.4.2 饱和碳原子上的亲核取代反应机理与立体化学
主要分为两类:
- 双分子亲核取代
\(\ce{CH3Br + OH- -> CH3OH + Br-}\)
溴甲烷水解为二级反应,\(\ce{v=\kappa[CH3Br][OH-]}\) - 单分子亲核取代
\(\ce{(CH3)3CBr + H2O -> (CH3)3COH + HBr}\)
叔丁基水解为一级反应,\(\ce{v=\kappa[(CH3)3CBr]}\)
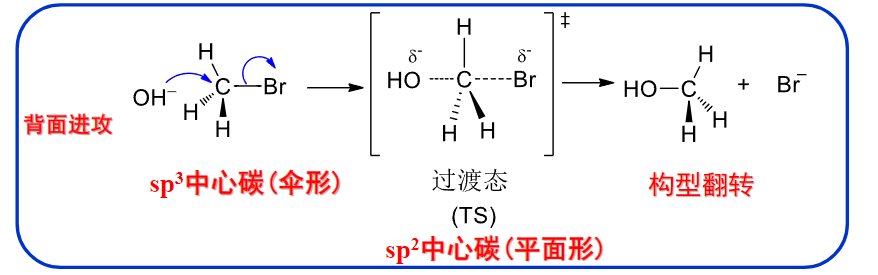
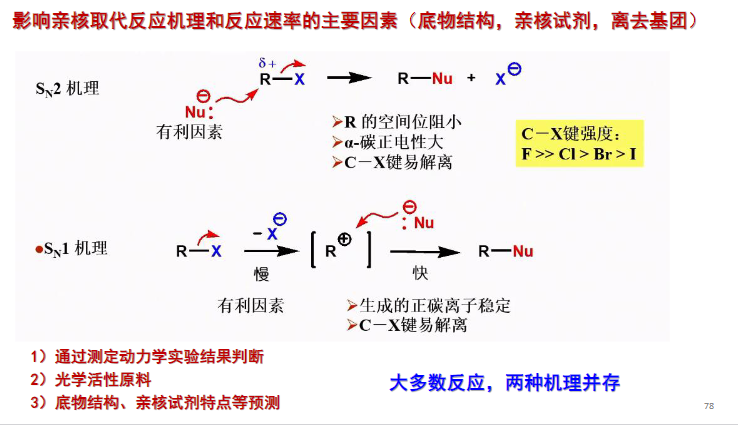
8.4.2.1 SN2机理
\(S_N2\)机理
协同反应:\(\ce{C-X}\)的断裂与\(\ce{C-O}\)的形成同时进行。其具体反应机理如下:
空间位阻越小,则形成过渡态越有利。反应越容易
该反应具有三个特征:
- 卤代烃的反应活性顺序:\(\ce{CH3X>RCH2X>R2CHX>R3CX}\)
- Walden转化:分子外消旋化(见下图)
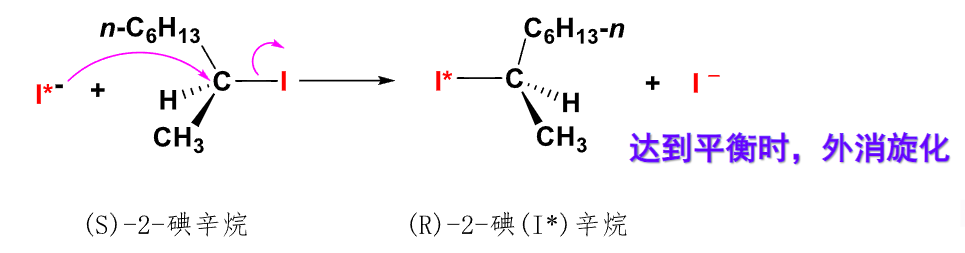
这是检验是否是\(S_N2\)机理的重要特征!!! - 反应难易:亲核试剂的亲核能力越强,反应越容易进行,反应速率与亲核试剂浓度有关。
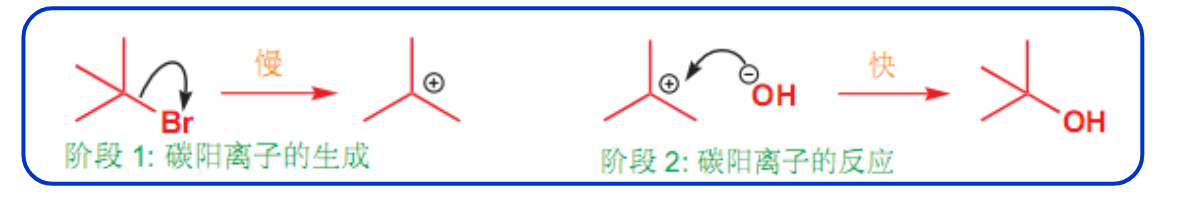
8.4.2.2 SN1机理
\(S_N1\)机理
分布反应:\(\ce{C-X}\)的断裂与\(\ce{C-O}\)的形成分步进行。整个反应的决速步是\(\ce{C-X}\)的断裂,具体机理如下:
一个经典的\(S_N1\)机理反应如下:
对于这个反应来说,中间体的碳正离子越稳定,反应越容易进行。
其同样具有三个特征:
- 卤代烃的反应活性顺序:\(\ce{R3CX>R2CHX>RCH2X>CH3X}\)
- 立体化学:产物为外消旋物(两侧进攻概率相同)。
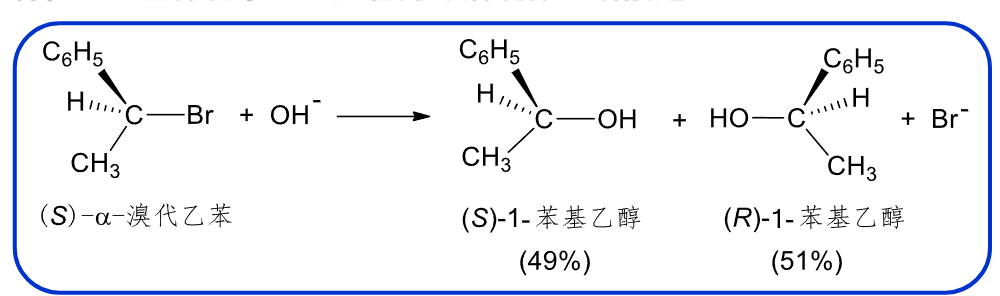
当然也有可能构型翻转的产物较多一点。 - 易重排:由于反应的中间体有一个碳正离子,所以容易发生重排反应。重排的驱动力:生成更稳定的碳正离子
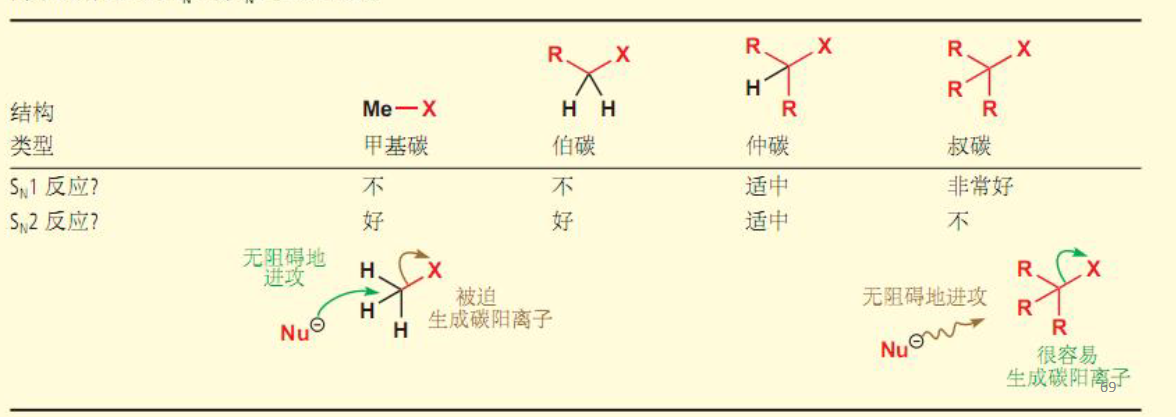
8.4.2.3 SN2与SN1总结
8.4.2.4 邻近基团参与机理
\(\beta\)-位有亲核基团参与亲核取代反应: 反应速度加快,产物具有立体化学专一性。
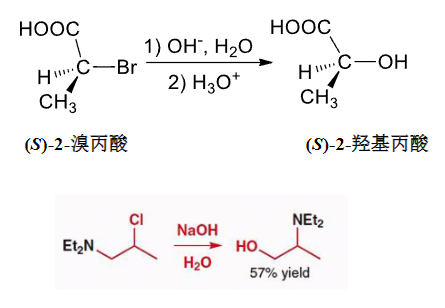
\(\ce{-COOH}\)和\(\ce{-NEt2}\)都是强亲核基团,让两个反应出现了一些不同寻常的特征:
第一个反应中,先有羧基发生\(S_N2\)反应:
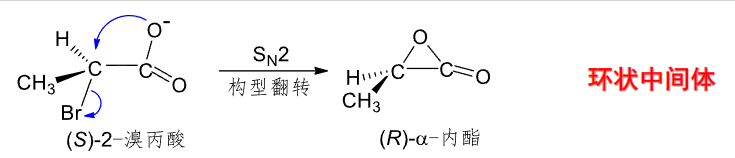
然后羟基再来进行\(S_N2\)反应:
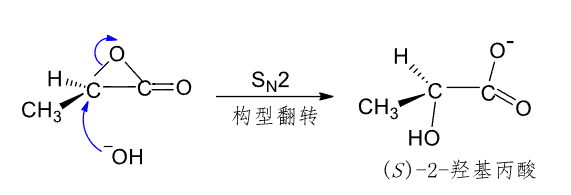
第二个反应也类似:
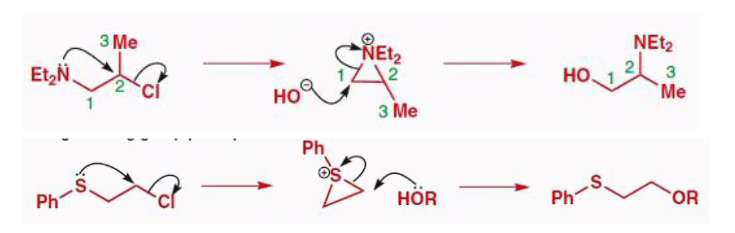
以\(\ce{O、S、X}\)等杂原子(亲核基团)都容易发生邻基参与。
特别注意:邻近基团处于离去基团的反位,才能从离去基团的背面进攻中心碳原子。
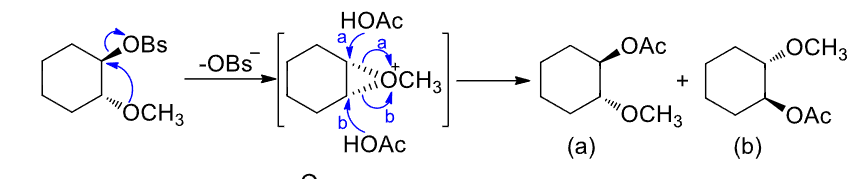
苯环也可以:
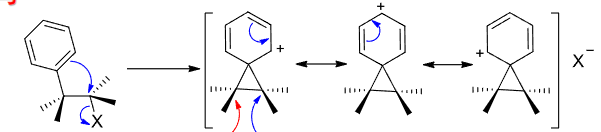
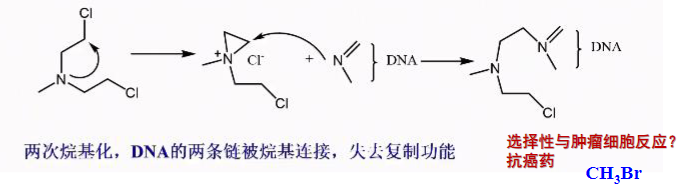
具体实例如下(芥子气):
8.4.2.5 总结
8.4.3 影响亲核取代反应速度的因素
8.4.3.1 离去集团的离去能力
离去能力的两个决定性因素:
- \(\ce{C-L}\)的键能
- \(\ce{L-}\)的稳定性
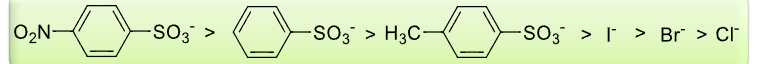
8.4.3.2 底物烃基结构
烃基结构将影响空间位阻与电子效应。
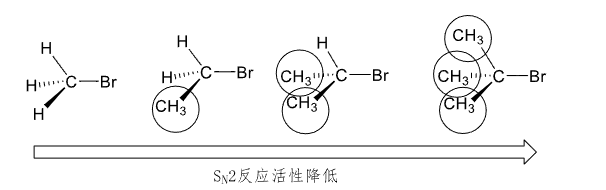
α-碳连接烷基越多,位阻越大,反应速度越慢。
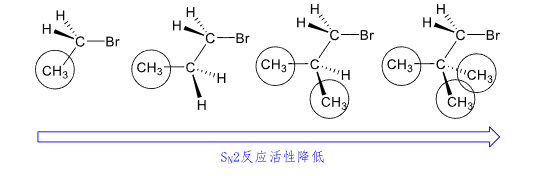
β-碳上的取代基越多,空间位阻变大,亲核试剂进攻α碳变难,反应速度变慢。
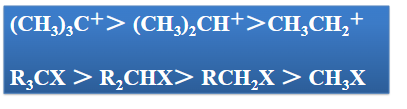
我们来看看一些“顽固不化”的:
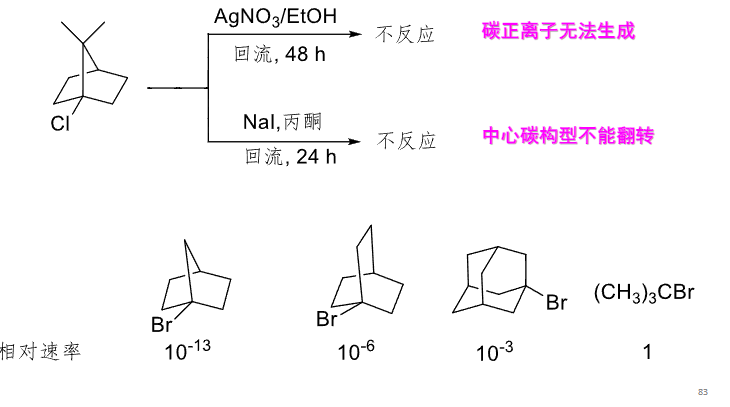
再来看点特殊的:
烯丙基/苄基型卤代烃容易发生SN1反应:p-π共轭效应稳定了中间体。
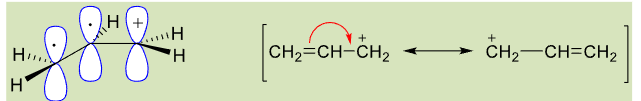
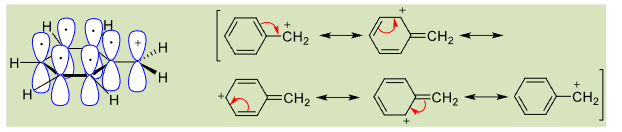
8.4.3.3 亲核试剂的亲核性
8.4.3.4 溶剂性质
8.5 卤代烷烃的消除反应
卤代烷烃的消除反应主要可以分为以下三类:
- 双分子消除反应E2
- 单分子消除反应E1
- 单分子共轭碱消除反应E1cb
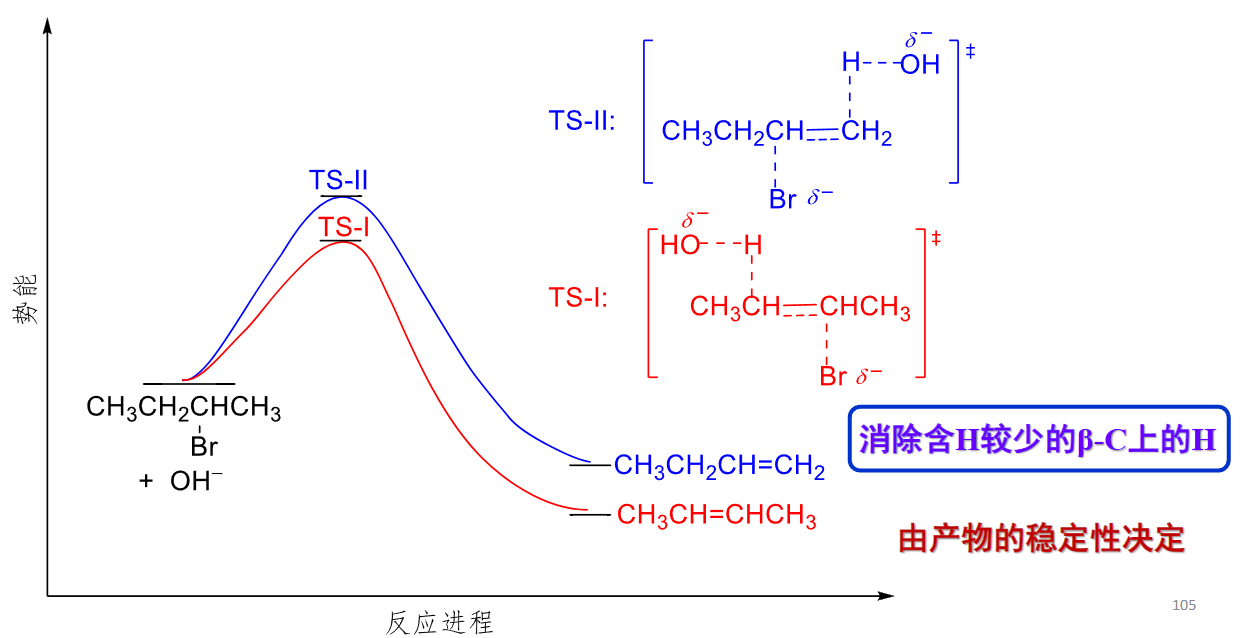
区域选择性——Saytzeff rule
消除发生在含氢较少的β碳上的H,主要生成双键碳原子上连有较多取代基的烯烃。
8.5.1 双分子消除反应E2
双分子消除反应
生成产物:烯烃 产物空间构型:反式构型大多数卤代烃在碱性条件下遵循E1机理。
8.5.1.1 反应机理
E2反应的机理如下:
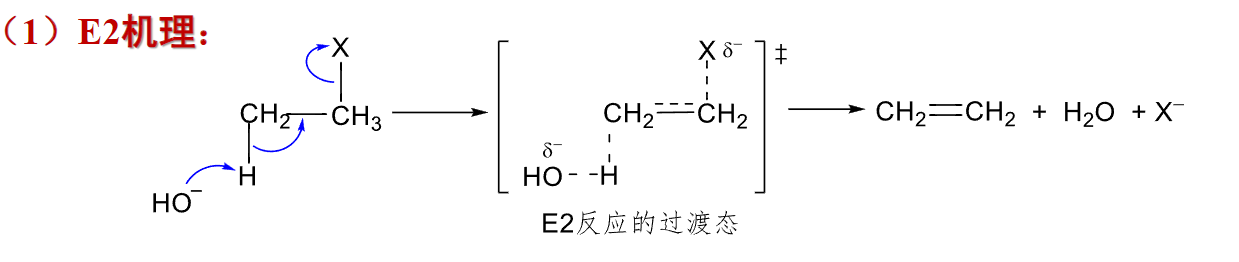
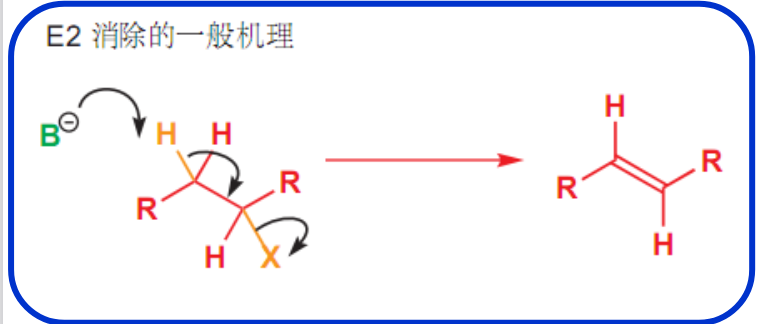
反应活性规律:
如下过渡态类似于烯烃结构,烷基越多越稳定。
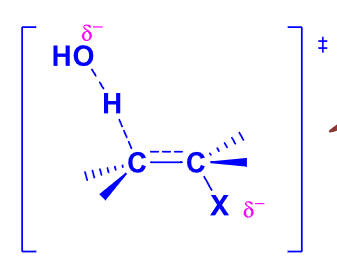
试剂碱性越强,β-C-H越容易断裂,反应越容易进行;离去基团越容易离去,反应越容易进行。
8.5.1.2 区域选择性
根据Saytzeff rule,其区域选择性可以如下解释:
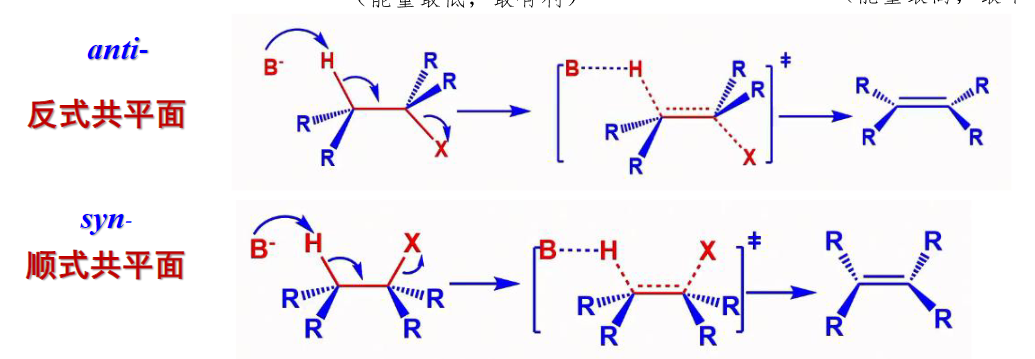
8.5.1.3 立体化学
E2消除反应的发生可以从两个不同的构型开始——顺势构型与反式构型。
对于卤代环状烃来说也是一样的:
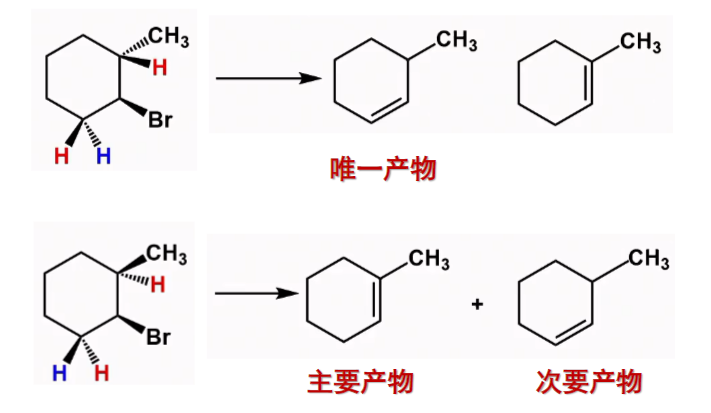
特别地,卤代环状烃来说,反式共平面的消除条件是X和β-H必须处于椅式构象的两个a键。
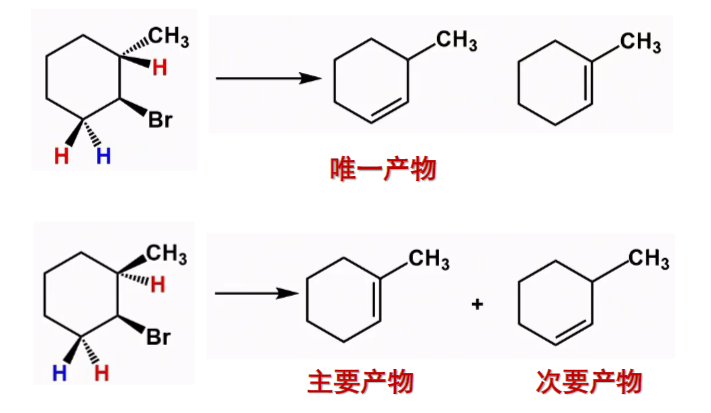
8.5.2 单分子消除反应E1
单分子消除反应
生成产物:烯烃无碱性或弱碱性条件下,叔卤代烃的消除一般是E1机理。
补充:本质上卤代烃的反应机理取决于\(\ce{C-X}\)键和\(\ce{C-H}\)键断裂的相对速度,如果两者相近,则以E2为主;如果\(\ce{C-X}\)远大于后者,则以E1为主。
更加绝对一点,除非弱碱下,才会发生E1反应(醇,水等)。
8.5.2.1 反应机理
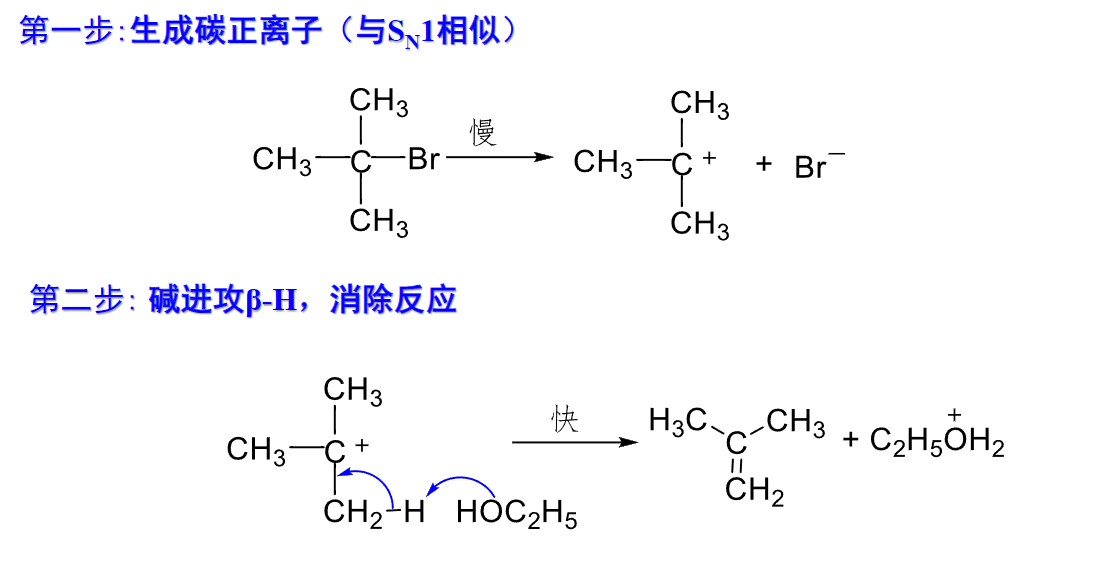
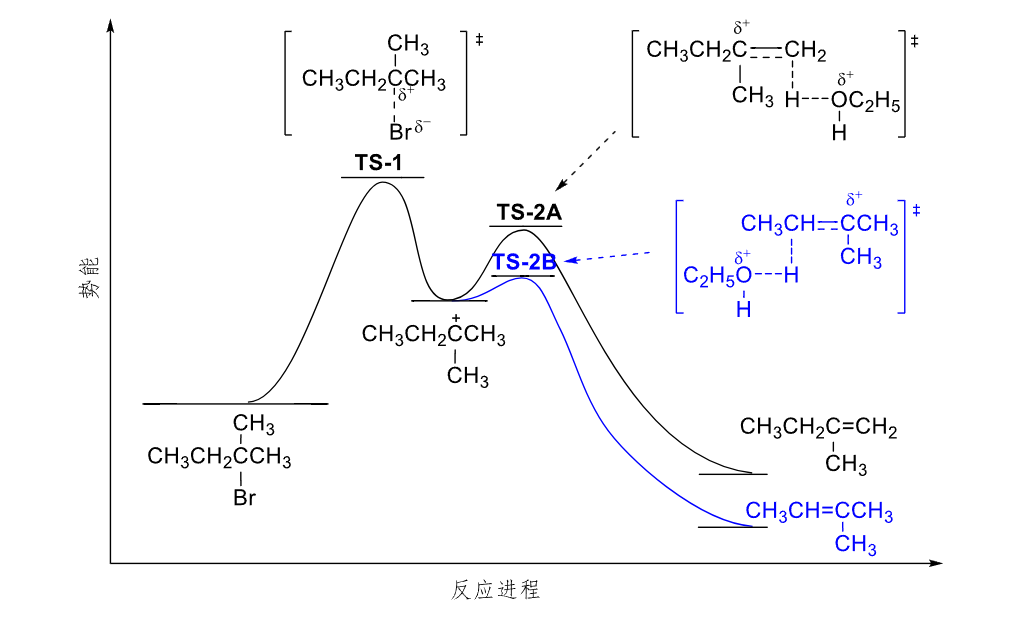
由于其中出现了类似于\(S_N1\)的碳正离子,E1机理同样会出现碳正离子重排的情况。
8.5.2.2 区域选择性
根据Saytzeff rule,有:
8.5.3 单分子共轭碱消除反应E1cb
8.5.4 消除反应与取代反应的竞争
8.7 卤代烃与金属的反应:金属的有机化合物(R-M)
8.7.1 有机镁化合物
格式试剂
$$ \ce{R-X + Mg \xrightarrow{无水乙醚} R-MgX} $$格式试剂充当亲核试剂,其烃基富电子
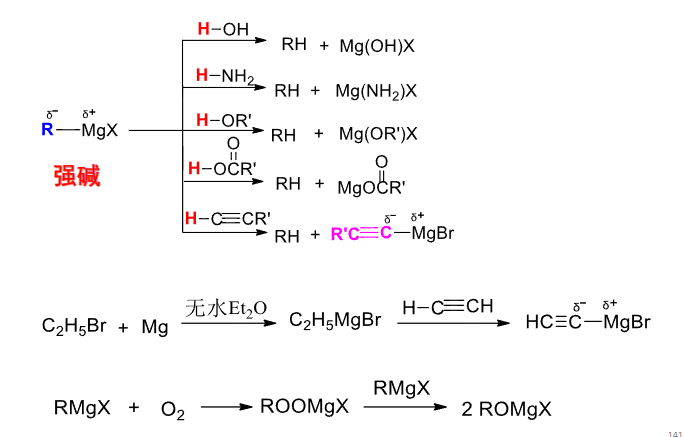
格式试剂比较重要的是烃基之间的偶联反应:
其通常是一个\(S_N2\)反应。
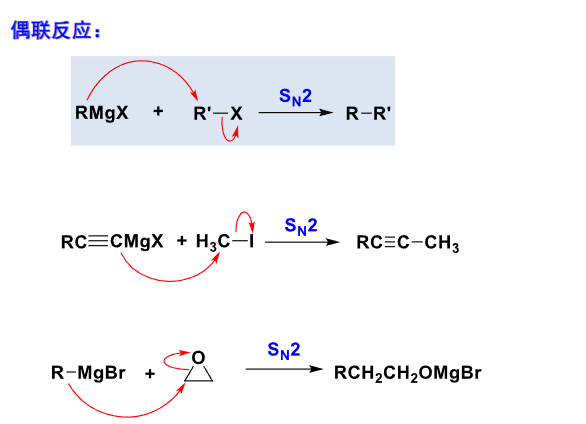
其除了偶联反应外,还可以与水、醇、醚等反应:
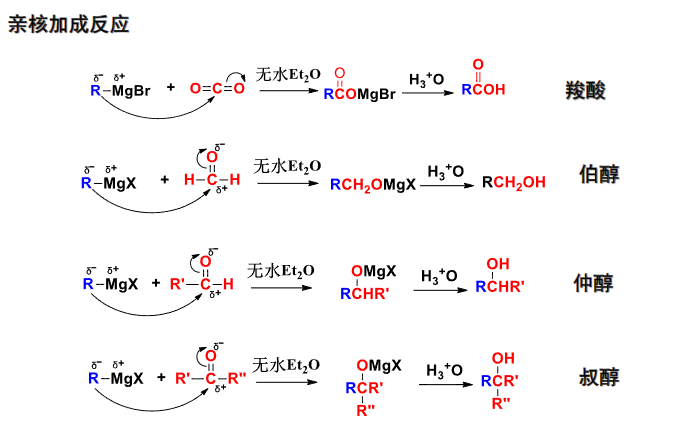
该反应主要生成醇。
8.7.2 有机锂化合物
有机锂化合物
$$ \ce{R-X + 2Li -> R-Li + LiX} $$有机锂化合物是强亲核试剂,具有很强的还原性。
常见的制备反应如下:
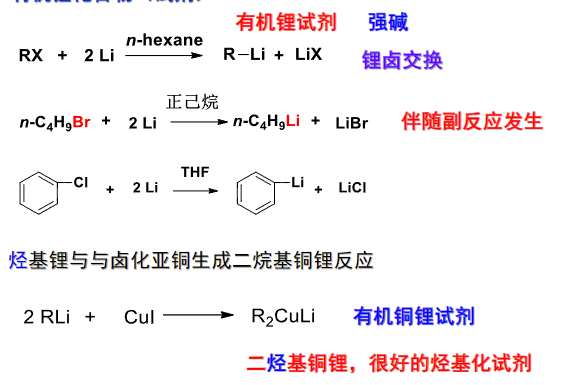
有机锂化合物是很好的羟基化试剂。
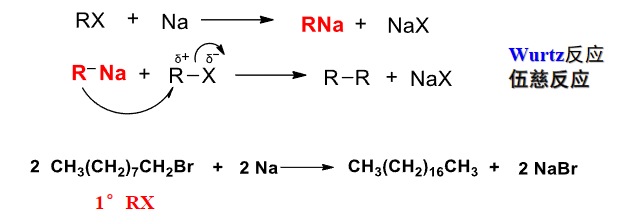
8.7.3 卤代烃与金属钠反应
卤代烃与钠反应
$$ \ce{2RX + 2Na -> R-R + 2NaX} $$