第十一章 羧酸及其衍生物
11.1 羧酸及其衍生物的结构和命名
11.1.1 羧酸及其衍生物的结构
羧酸的衍生物包括有:酯基、酰胺、酸酐等等。
11.1.2 羧酸及其衍生物命名
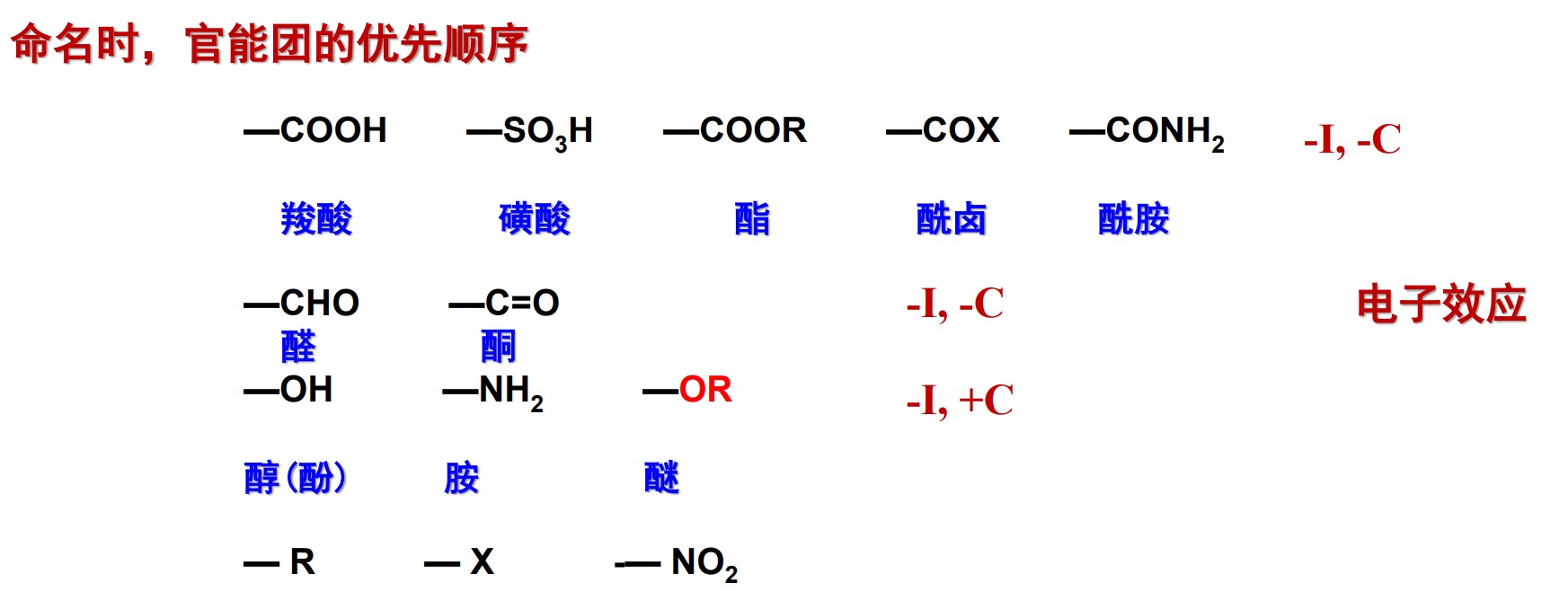
系统命名法:
选择含有羧基的最长碳链为主链,从羧基碳原子开始编号,称为“某酸”,如有取代基,将取代基的名称与位次放在前面。
芳香酸则一般以苯甲酸为母体,加上取代基名称与位置。
酰卤由相应酰基和卤素来命名,比如丙酰溴\((\ce{CH3CH2COBr})\).
酯由相应酸和烃基命名,比如乙酸乙酯。
酰胺由酰基加“胺”命名,氮上取代基以N标出,比如N-乙基乙酰胺\((\ce{CH3CONHCH2CH3})\)。
酸酐的名称由相应的酸加“酐”构成,比如乙酸酐。
11.2 羧酸及其衍生物的物理性质
羧基本身可以形成两个氢键,所以羧酸的沸点和熔点都比相应的醇高。
11.3 羧酸的酸性
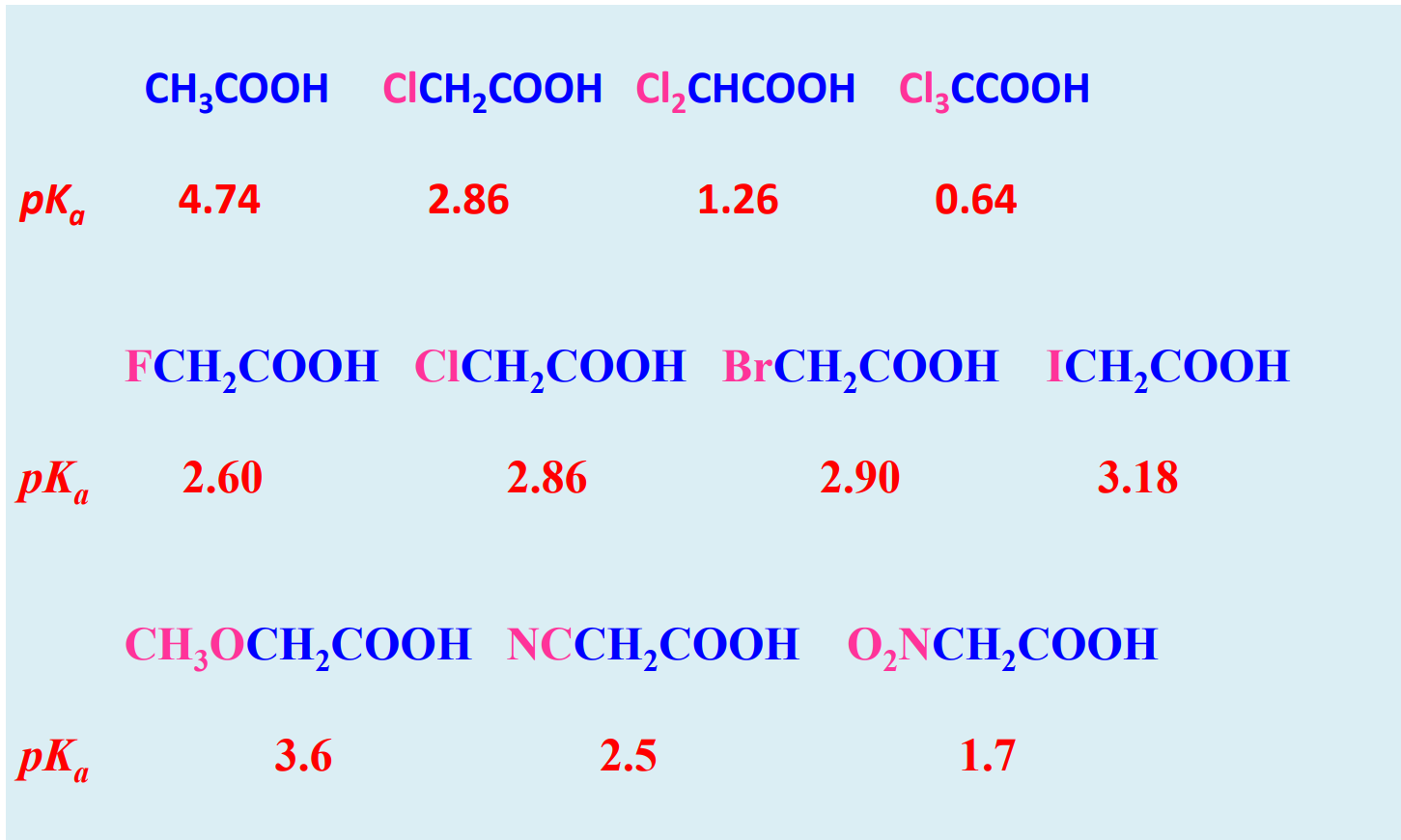
基本的酸性比较大小如下:

羧酸失去一个氢离子后,羧基碳和两个氧之间可以分担负电荷,非常稳定,其共轭碱碱性不强。
特别地,根据诱导效应,取代基也会对羧基的酸性产生影响:
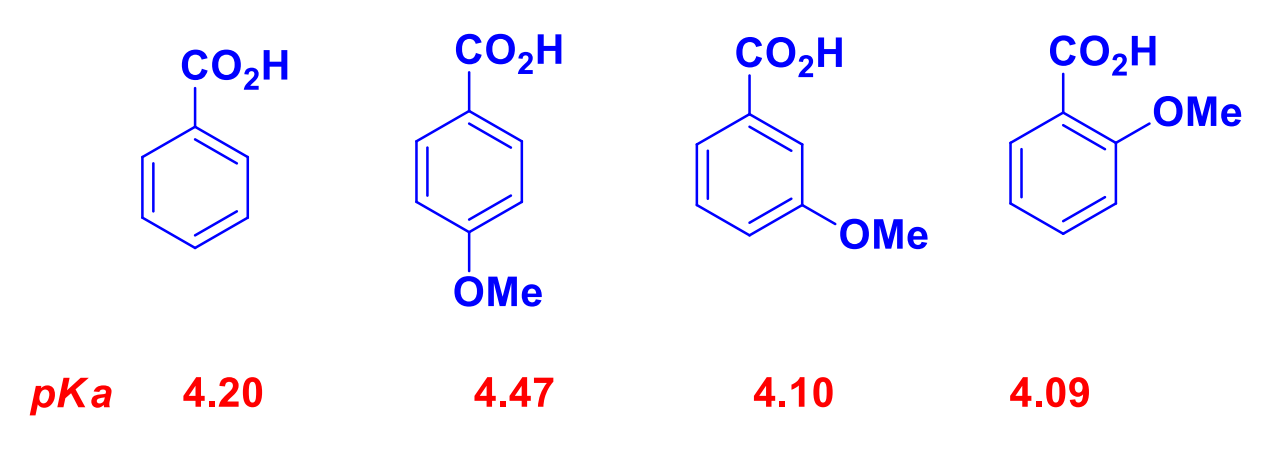
对于芳香酸,其芳环上取代基对羧基的影响包括了共轭效应与诱导效应,具体可见芳香烃那章的相关讨论。
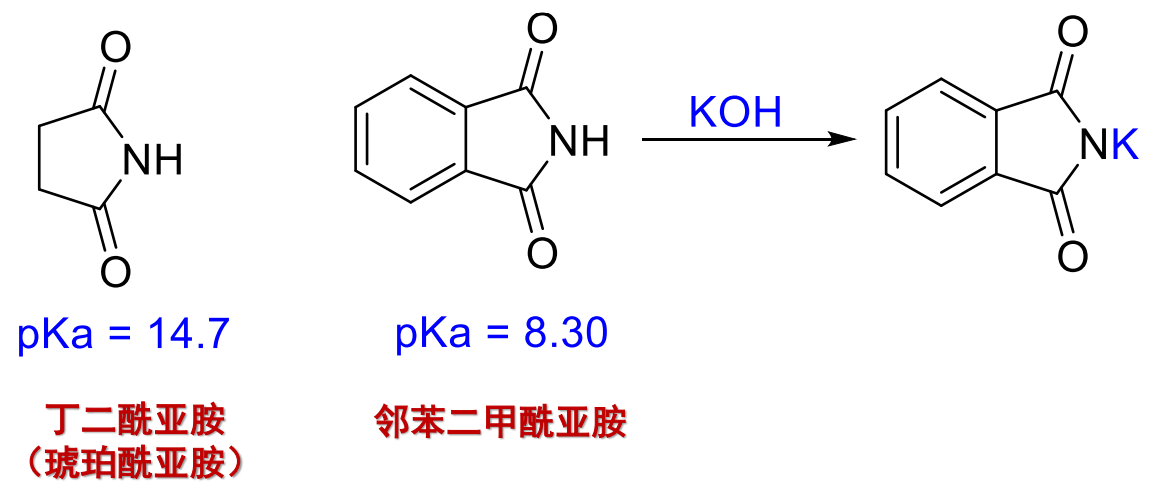
与一般烷基相连的酰胺的酸性和醇相近,有些酰胺基酸性较强:
11.4 羧酸衍生物的亲核取代反应
11.4.1 加成-消除反应
由于存在类似于醛/酮的羰基碳,其同样可以发生类似的亲核加成反应:
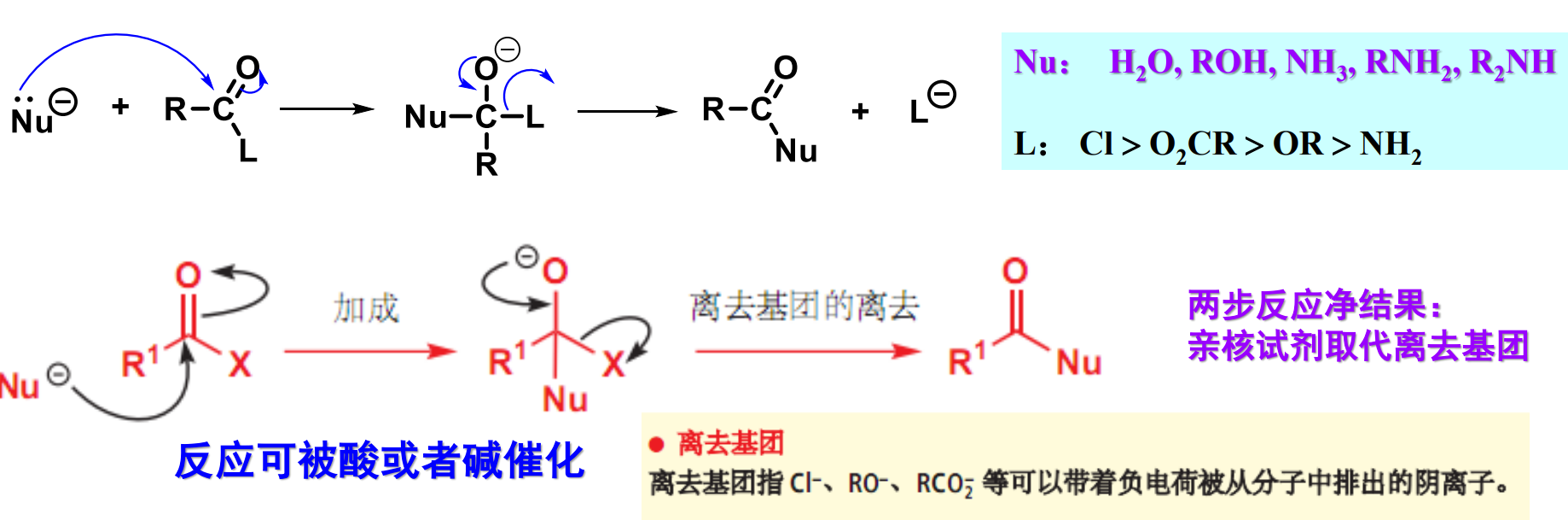
与醛酮不一样的是,羧酸衍生物的加成反应的净结果是离去基团被亲核基团所取代。
过程中发生了反共轭效应:带负电的氧给出一对电子,迫使离去基团离去。
特别的,这个反应可以被酸碱分别催化,其分别的反应途径是:
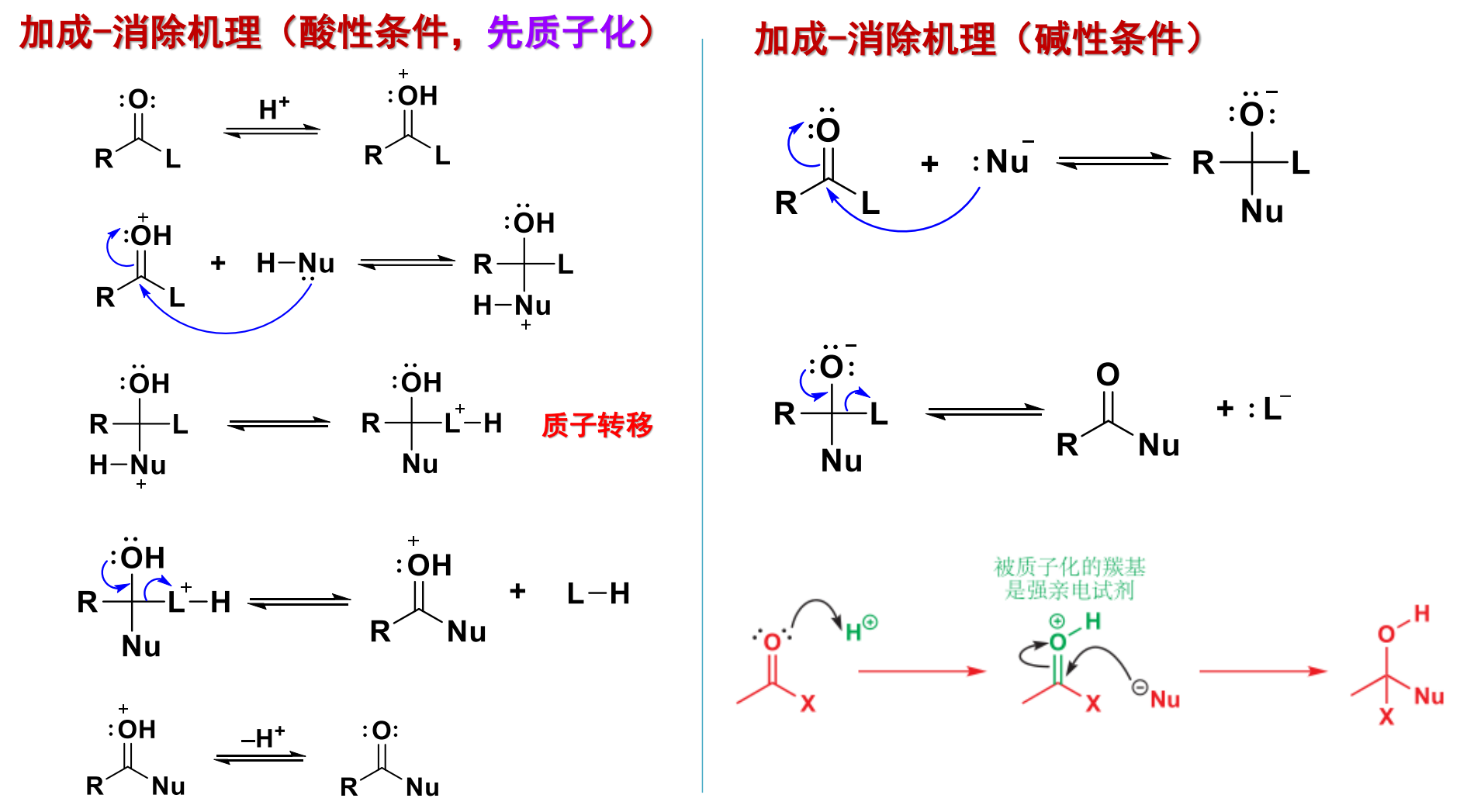
对于酸性条件下的加成-消除机理:
- 活化羰基:羰基氧接受质子,使其带上正电,使得其羰基碳亲电性增强。
- 亲核进攻:活化后的羰基更容易被进攻。
- 质子转移:亲核基团上的质子转移给离去基团。
- 反共轭:氧给出一对电子,迫使离去基团离去。
影响羧酸衍生物的亲核取代反应——先加成后消除的因素:
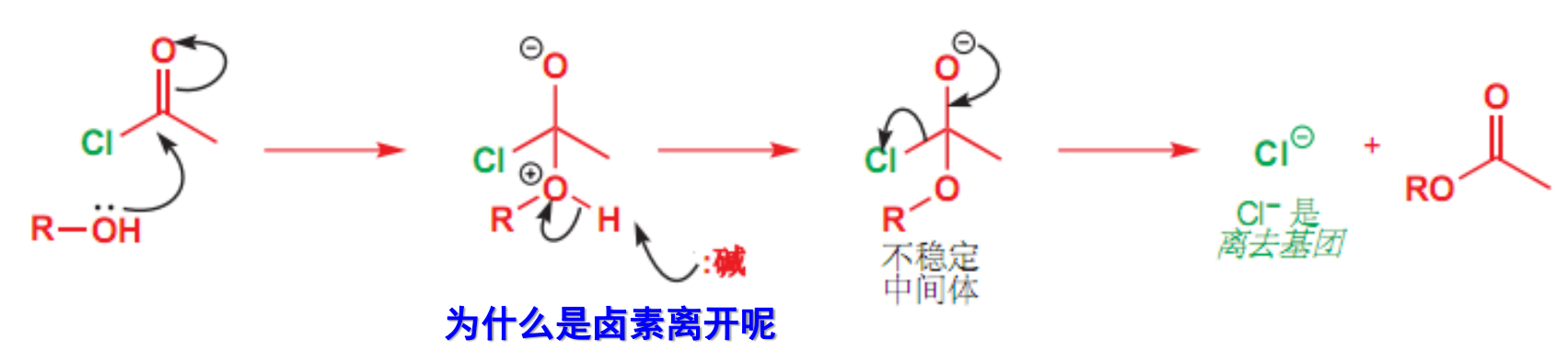
- 离去基团的离去能力:与羰基共轭能力越弱,越容易离去。常见的离去基团有\(\ce{Cl- >RCO2- > RO- > NH2-}\)
- 羰基碳缺电子程度
离去能力
从上面的比较可以看出,碱性大小和离去能力强弱是反着来的。这和我们在卤代烃亲和取代那一块的讨论是类似的。
11.4.2 醇解反应
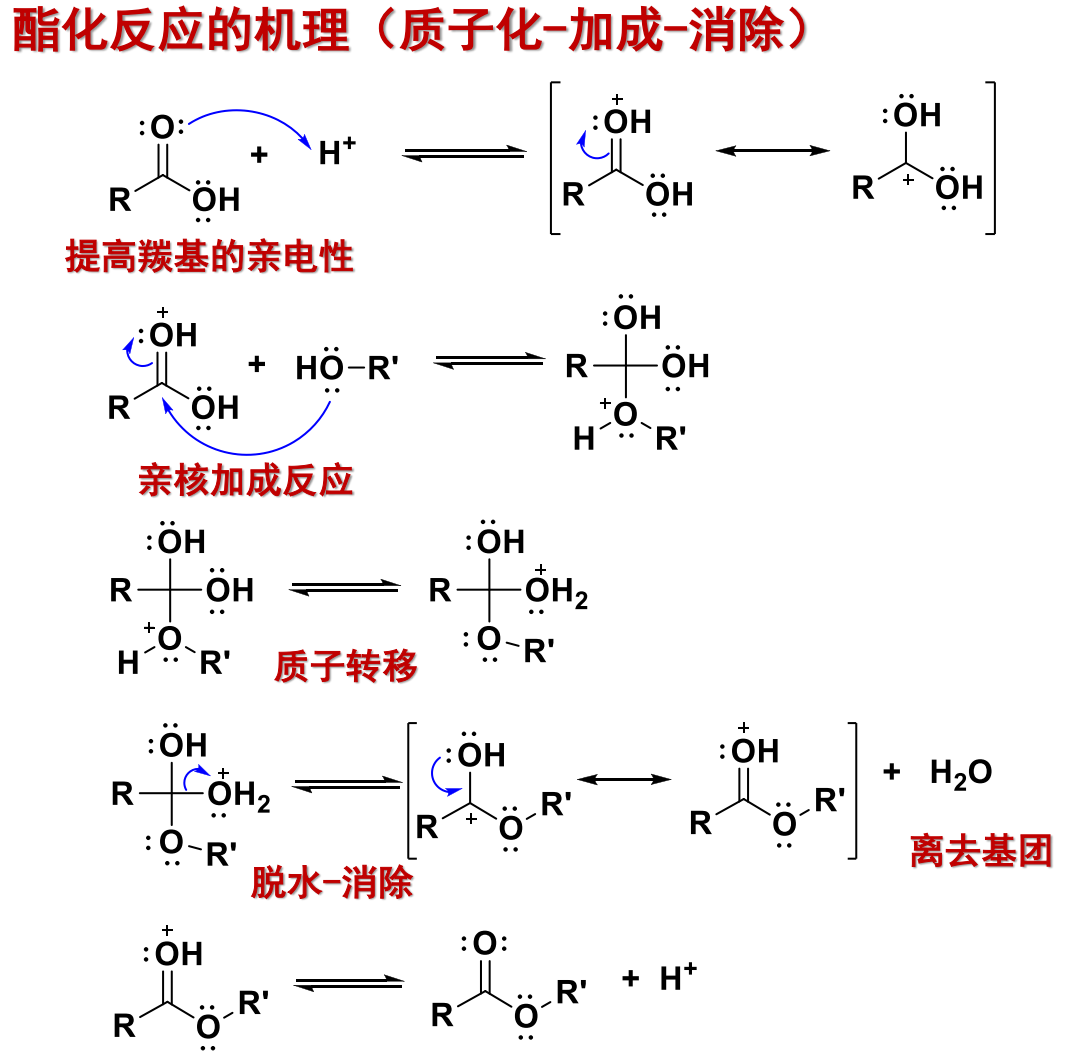
11.4.2.1 酯化反应
羧酸的醇解,也就是酯化反应,反应式如下:
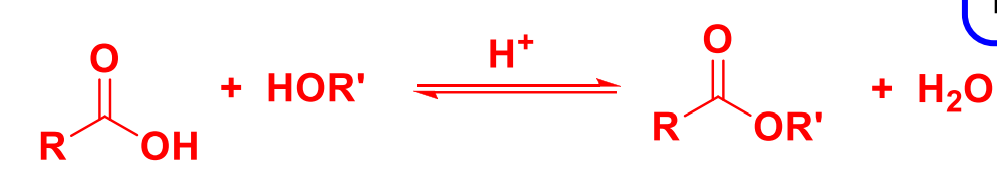
反应在酸催化下(最好是强吸水性的浓酸)进行。
一般采用浓\(\ce{H2SO4}\)、浓\(\ce{H3PO4}\)或者\(\ce{TsOH}\)。
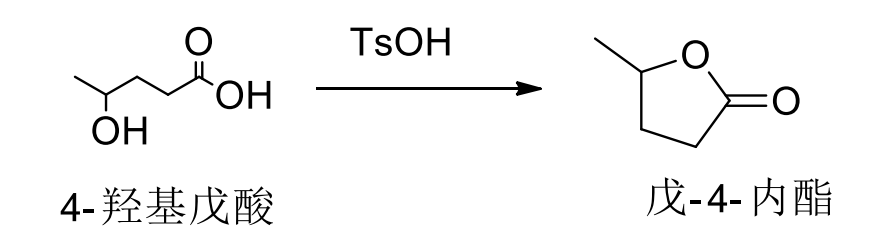
如果分子内存在合适位置的羟基与羧基,可以发生环化:
酯化反应的机理如下:
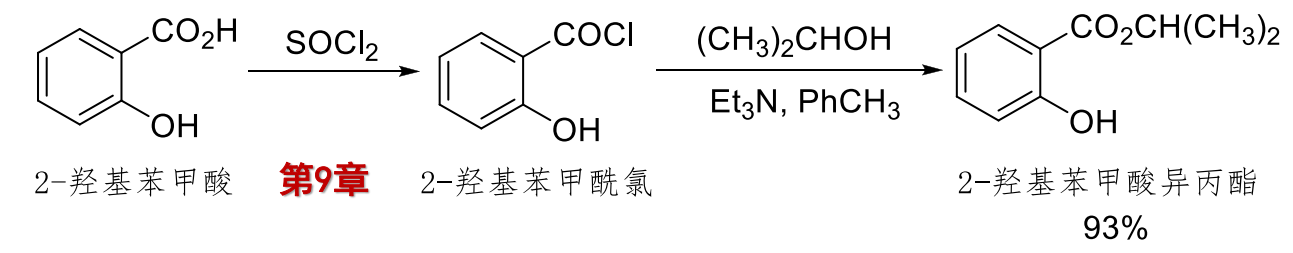
11.4.2.2 酰氯和酸酐醇解合成酯
酰卤的醇解:
其机理如下:
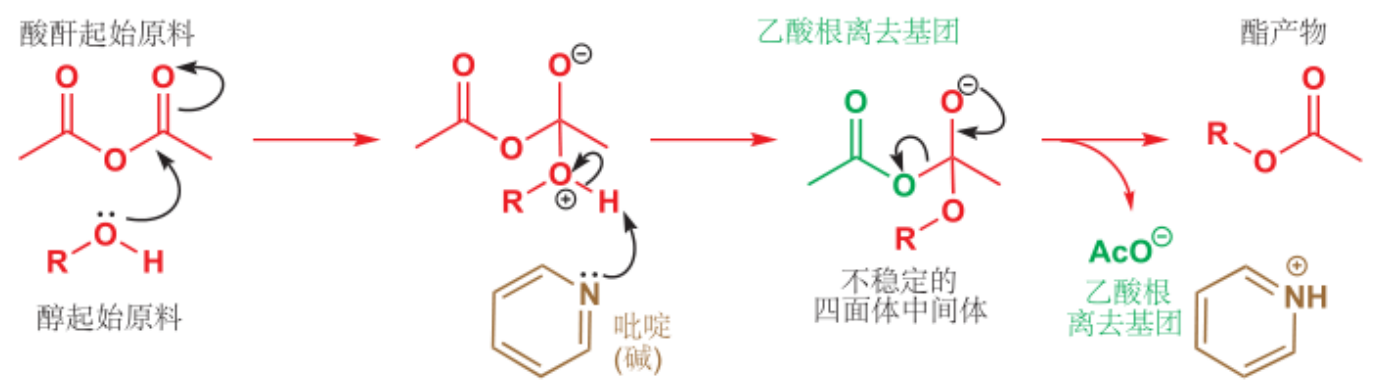
酸酐的醇(酚)解:
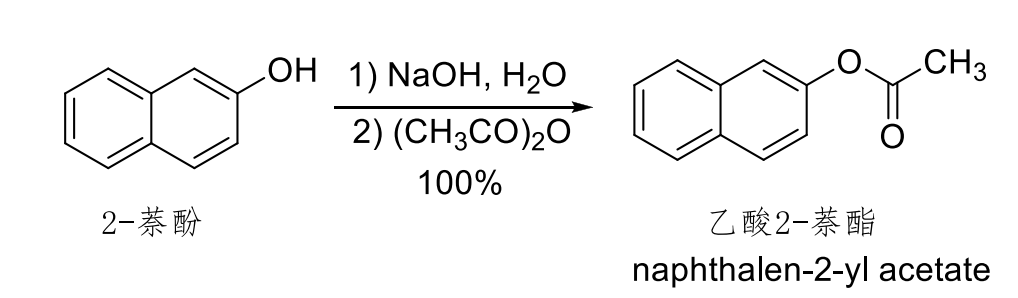
其机理如下:
11.4.2.3 酯的醇解
酯的醇解是一个很有用的反应,其就是一个酯交换反应。
反应如下:
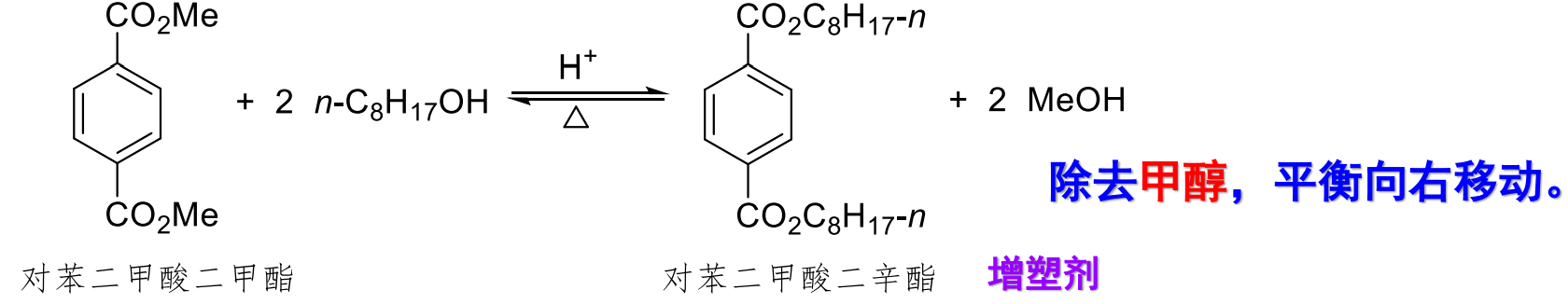
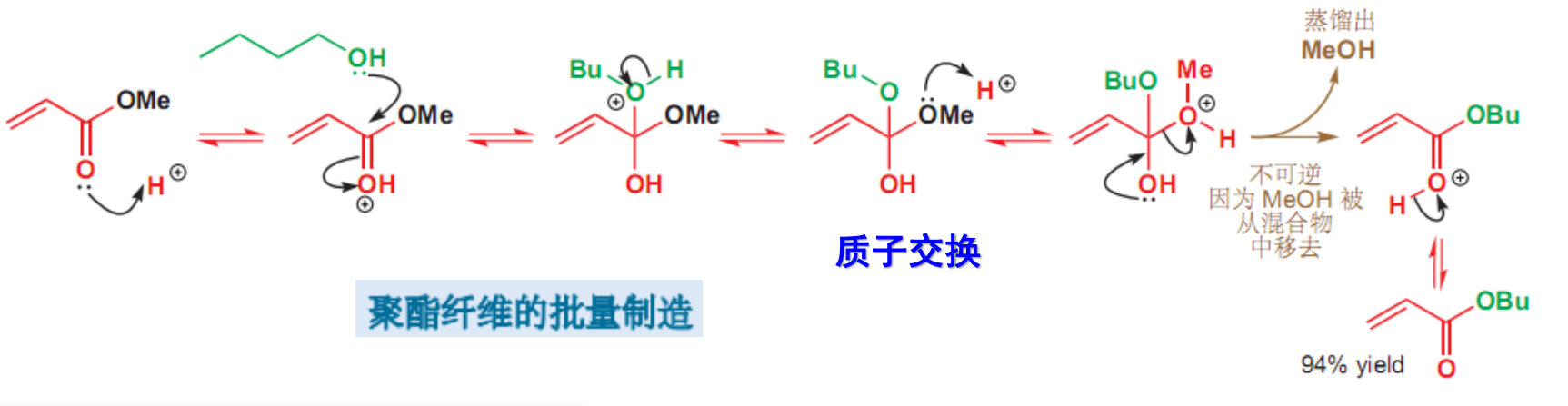
可以实现由简单酯合成复杂酯。反应机理如下:
11.4.2.4 叔醇酯化机理
叔醇的酯化反应机理特殊,其在酸催化下很容易脱去羟基,形成叔碳正离子:
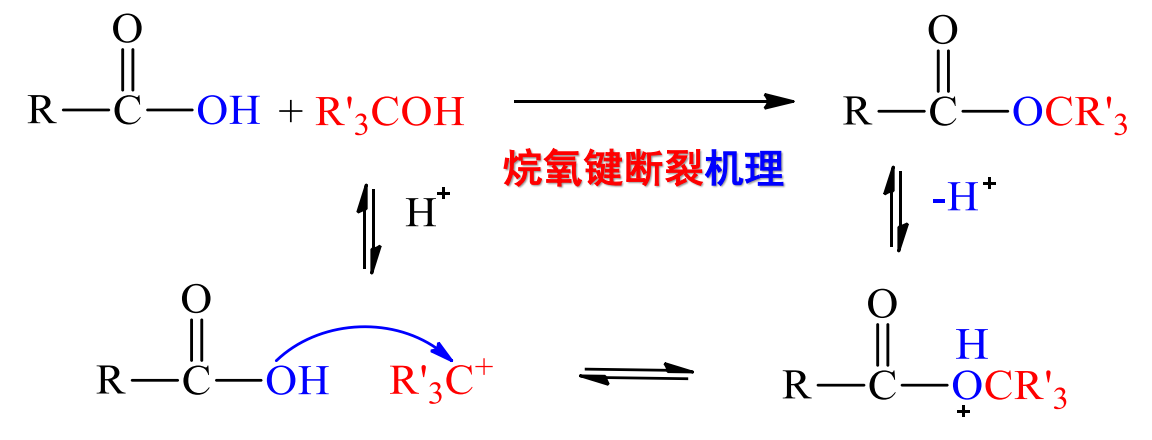
其断裂的键与一般的伯醇、仲醇的酯化反应不同。
11.4.3 水解反应
与前面醇类似,这里的水也作为亲核试剂进攻羰基碳。
常见的水解反应如下:
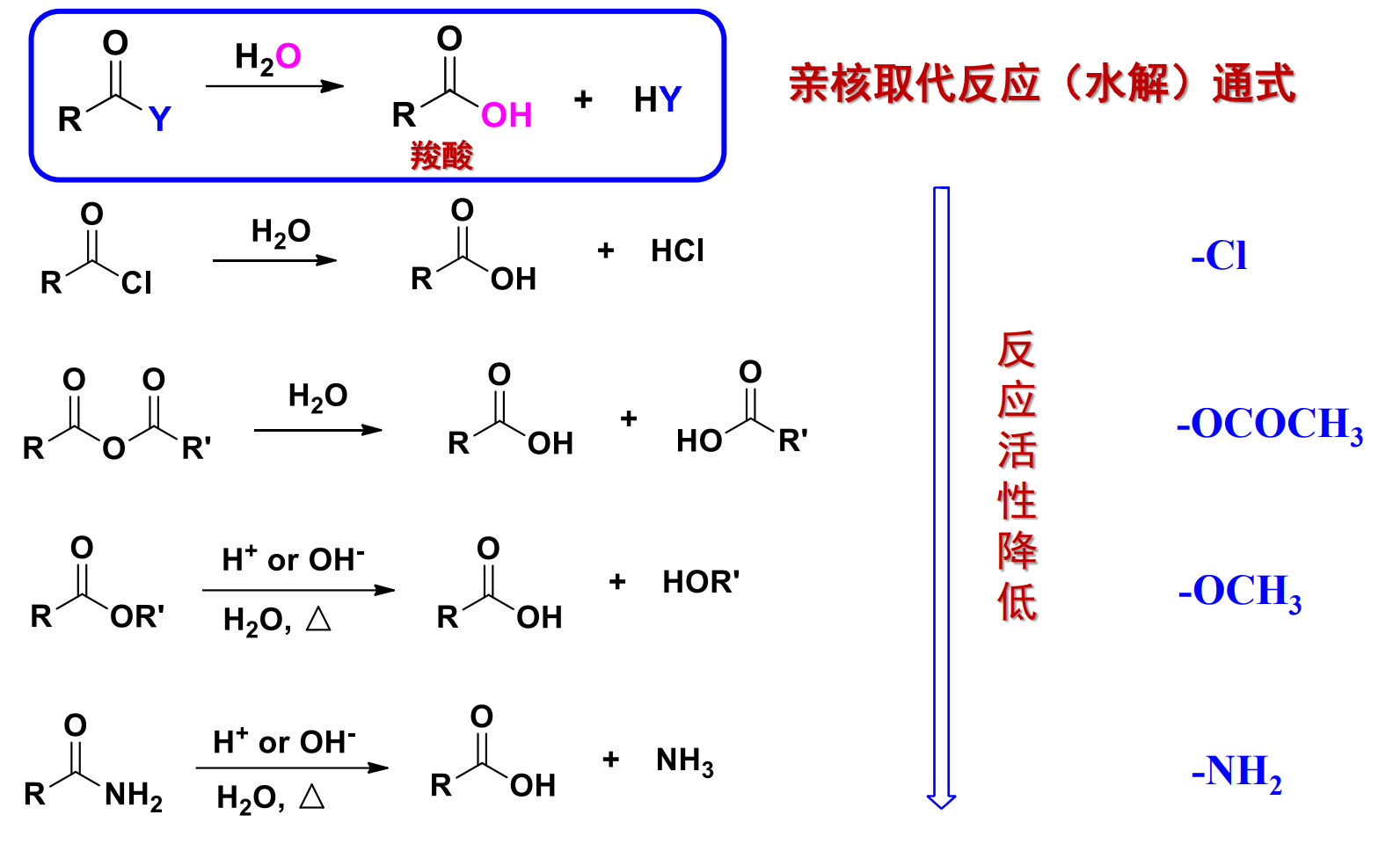
我们可以发现与前面对醇解反应的讨论类似,羧酸衍生物的水解反应速率同样与离去基团的离去能力正相关。
其可以被酸、碱分别催化,其反应机理如下:
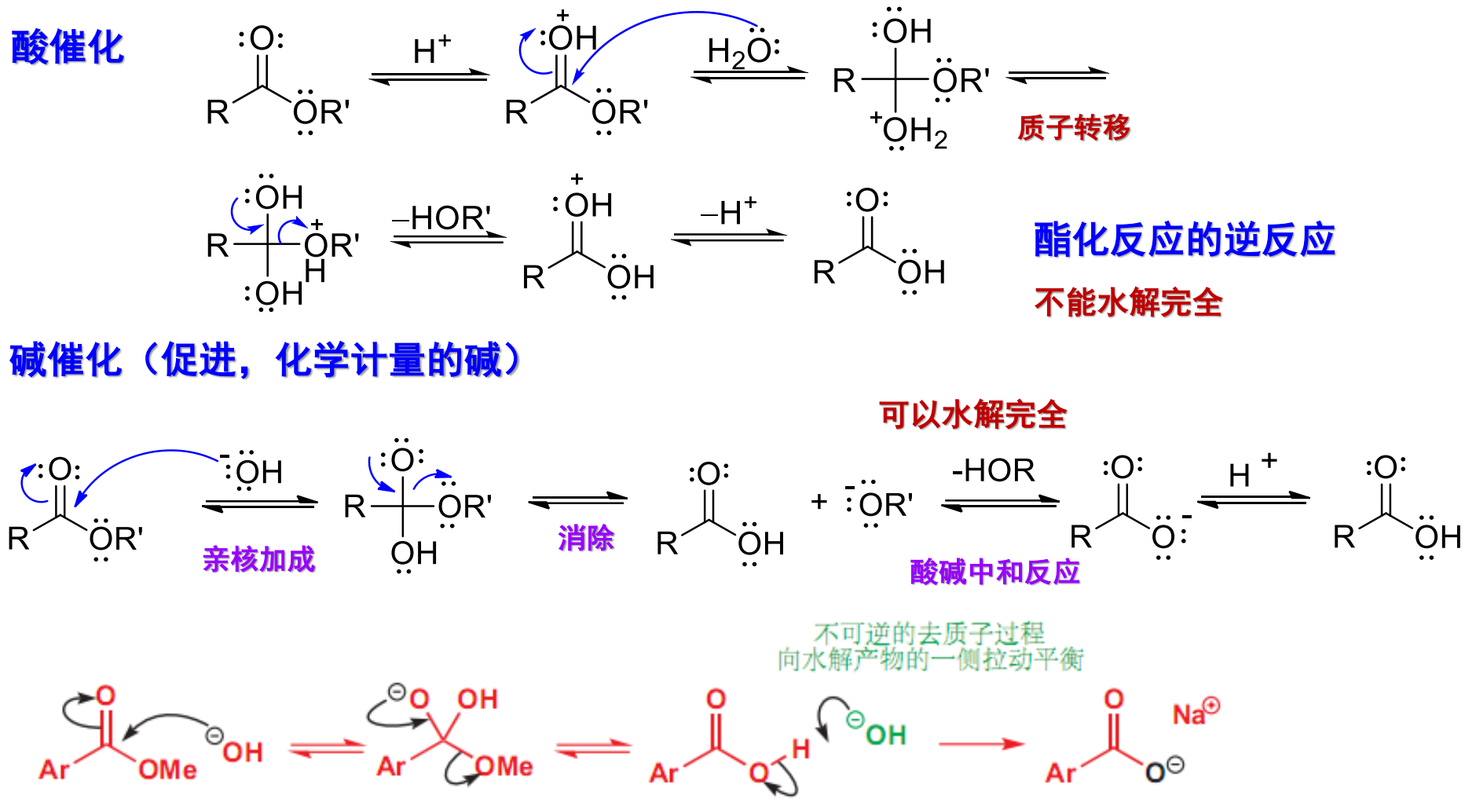
碱性条件下可以反应完全。