第十二章 羰基α-碳上的反应
12.1 羰基化合物 α-氢的酸性
12.1.1 酮-烯醇互变异构
互变异构
两种或两种以上的异构体能相互转变,并共存于动态平衡中,称为互变异构现象。
两者互变异构的循环图如下:
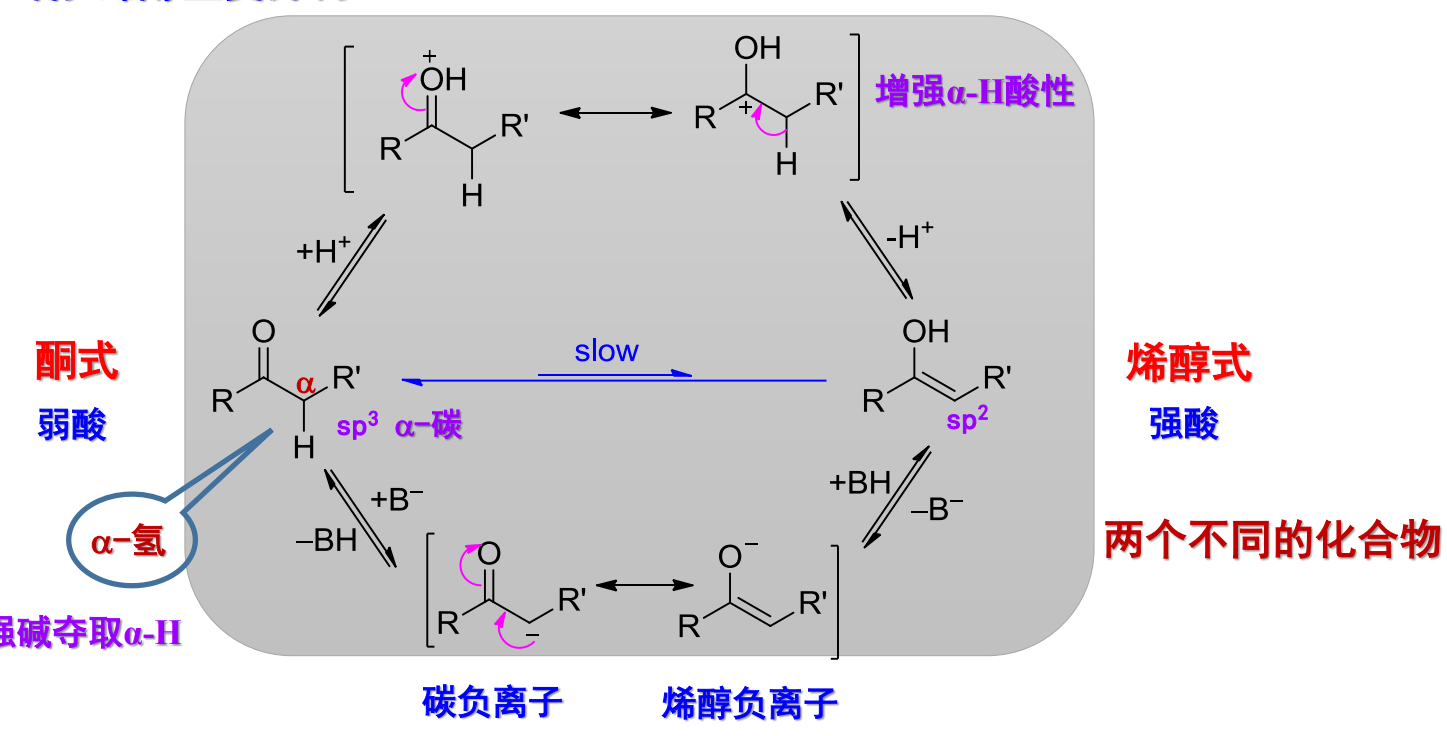
特别注意的是,互变异构的两个化合物不是同一个化合物。
酮-烯醇互变异构的反应通式为:
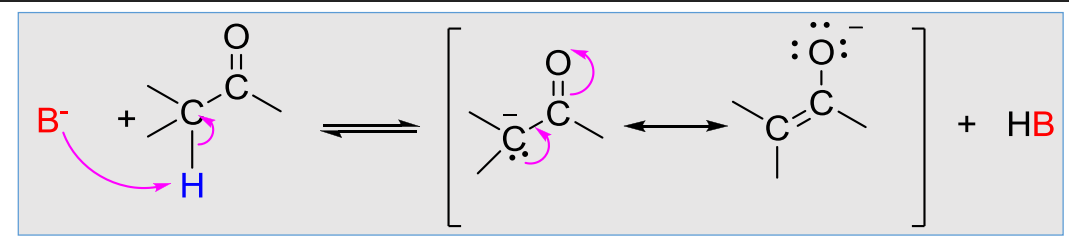
酮-烯醇互变异构反应的特点有:
- 此互变异构可逆
- 中性条件下很慢,酸/碱可以催化,但一般不改变平衡常数
- 大量强碱催化可以使平衡向烯醇负离子方向移动
反应举例如下:
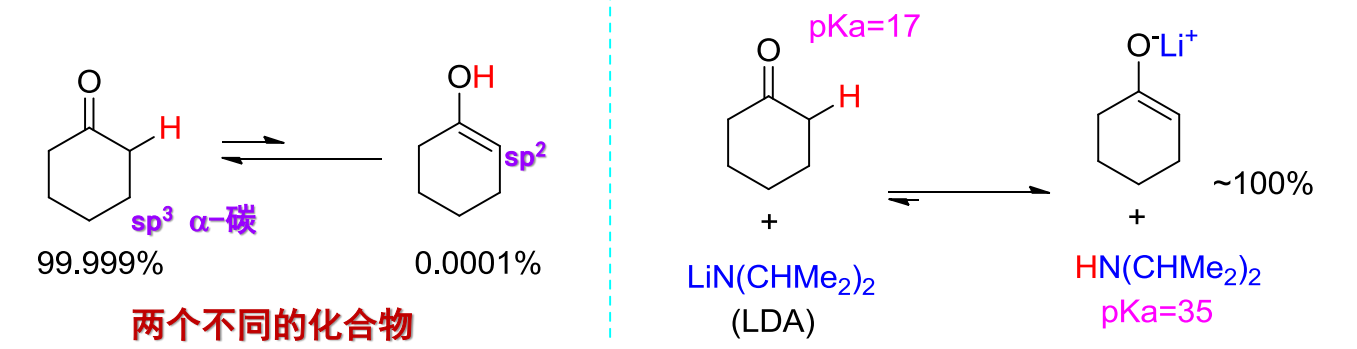
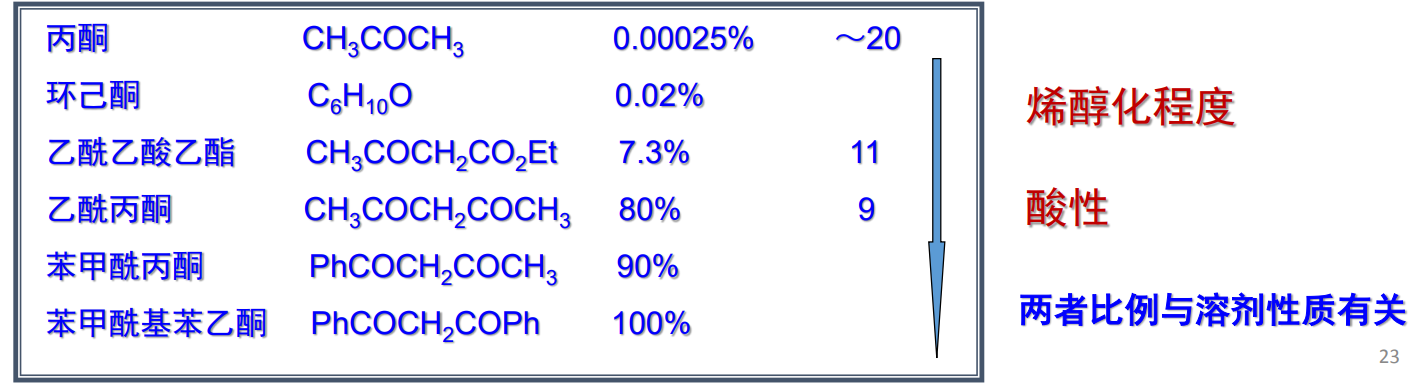
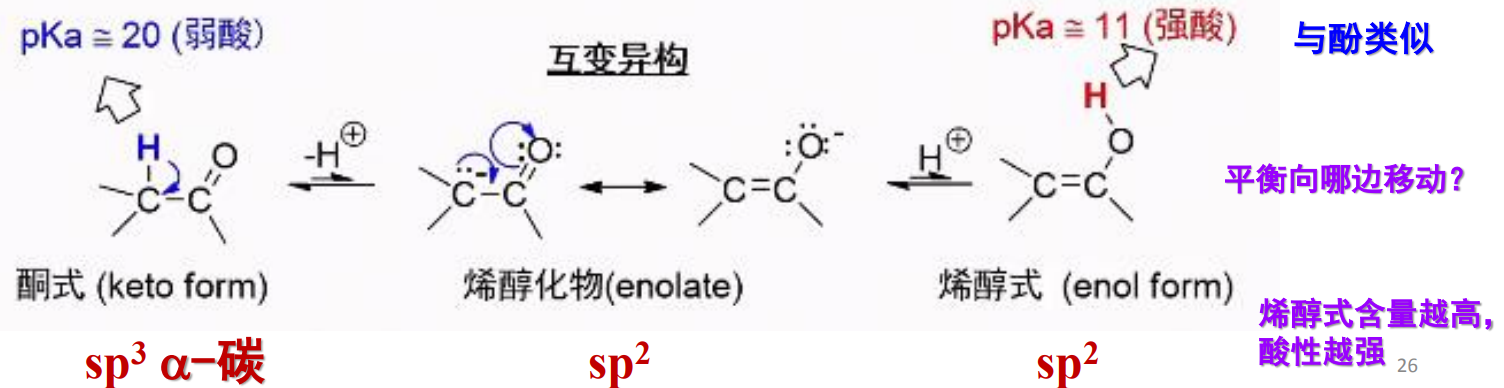
酮-烯醇互变异构反应的平衡常数主要受到化合物分子结构决定,特别地,酸性越强,烯醇式比例越大:
- 分子中的α-碳氢受到吸电子效应影响越强,酸性越强,越容易离去,转化为烯醇式。
- 烯醇型下的碳碳双键可以与其他官能团(羰基、苯基等等)形成共轭效应,稳定性越强,越容易形成烯醇式。
- 烯醇型可能形成分子内氢键,增强稳定性。
烯醇有如下性质:
- 与溴发生加成反应,使溴水褪色。
- 与氯化铁的乙醇溶液发生显色反应,溶液变紫红色。
- 与金属钠反应放出氢气。
- 与醋酸铜振荡时形成绿色铜络合物,从苯中得到的结晶熔点193℃
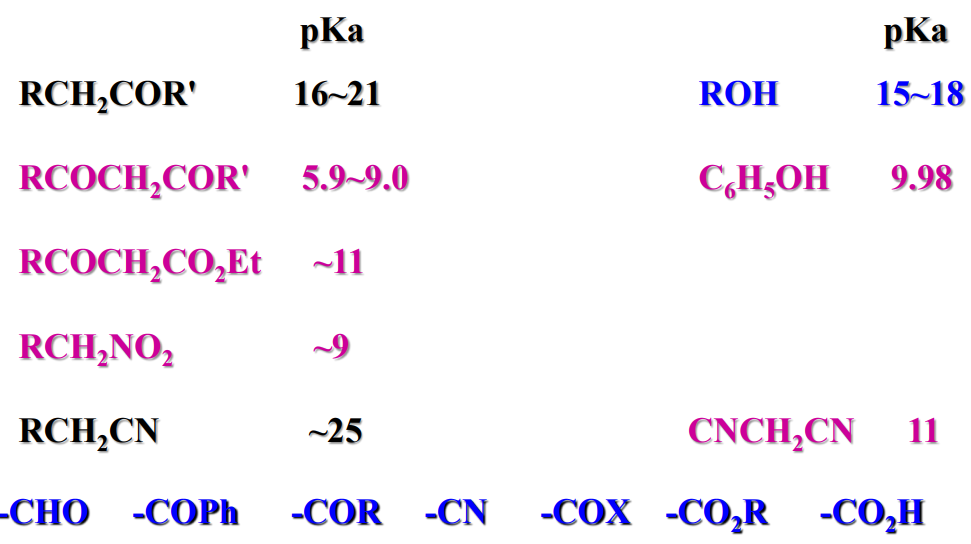
12.1.2 影响α-氢酸性的因素
一般情况下,影响α-氢酸性的因素一般为电子效应。
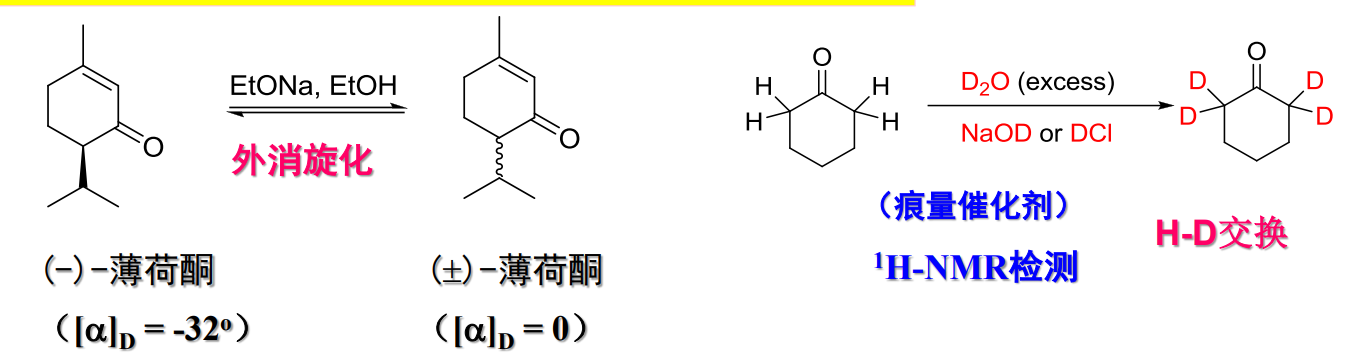
特别地,由于在互变异构中,α-碳上的氢与体系中质子存在交换,并且由烯醇式转化为酮时候,质子的进攻方向不确定,对于容易发生酮-烯醇互变异构的化合物来说,其存在外消旋化与H-D交换:
举例如下:
机理解释如下:
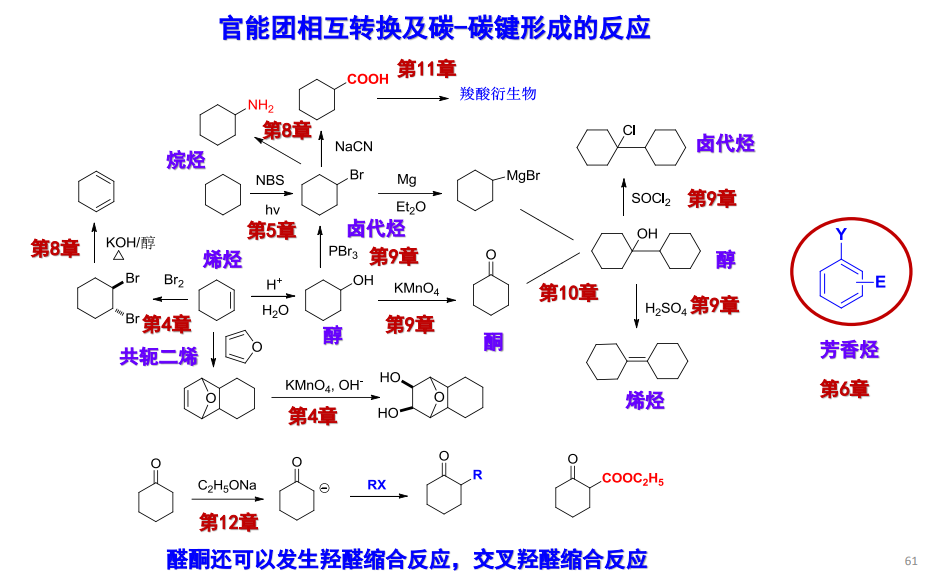
12.2 α-卤化反应
由于酮-烯醇互变异构产生的烯醇式具有较强的亲电反应活性,富电子的烯醇可以参与对亲电试剂的亲电进攻。
12.2.1 酮的α-卤化反应
酮的α-卤化反应通式如下:
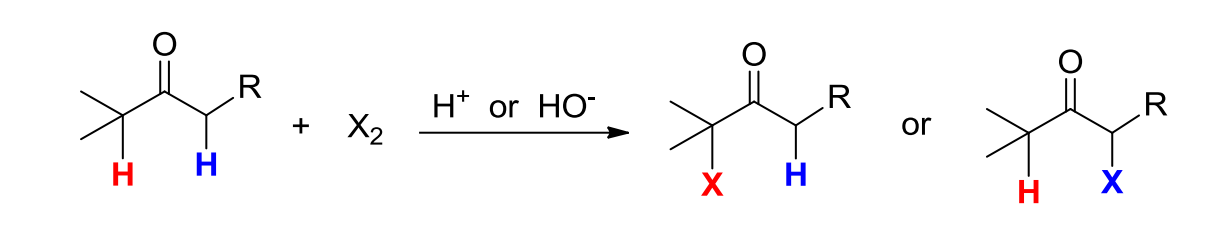
其中\(\ce{X=Cl、Br、I}\),酸碱均可催化该反应,但是反应的机理不尽相同。
反应举例如下:
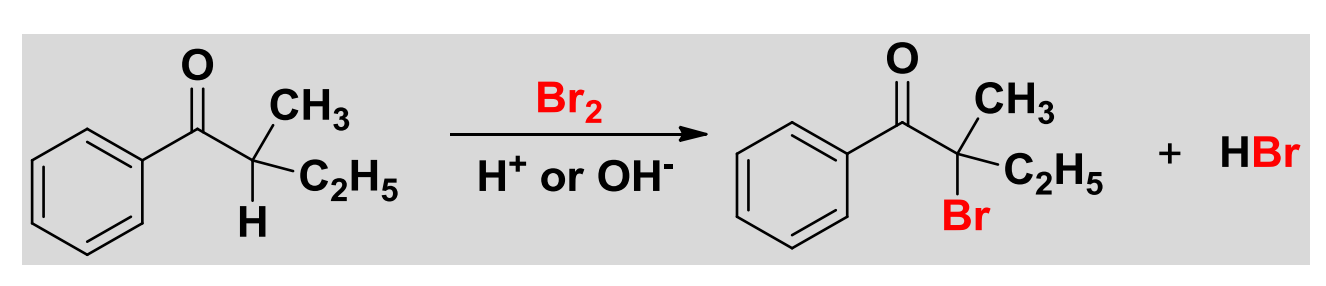
12.2.1.1 酸催化
酸催化下的α-卤化反应机理与烯烃的亲电加成反应类似,机理如下:
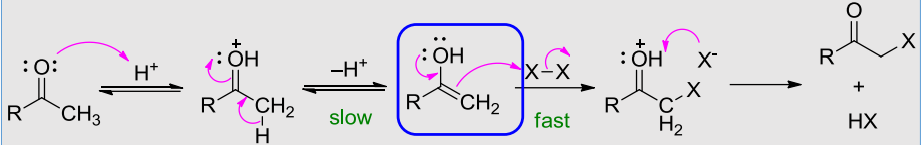
酸催化反应有如下特点:
- 反应只需催化量的质子酸
- 反应停留在生成一卤代物阶段
同样,在讨论酸催化反应的时候,我们也没办法避免讨论当羰基两侧不对称时候,卤代反应的区域选择性。
当有两种不同的α-氢时,区域选择性取决于烯醇的稳定性——共轭效应、取代基多少等等。双键上取代基多,及能形成共轭体系的易于烯醇化。
具体如下:
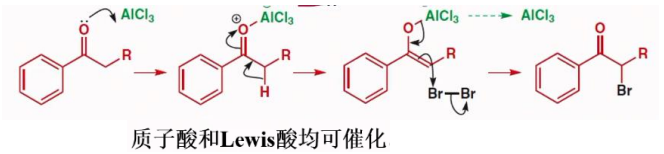
12.2.1.2 碱催化
碱性条件下发生的卤代反应机理与酸催化大相径庭,其反应机理如下:
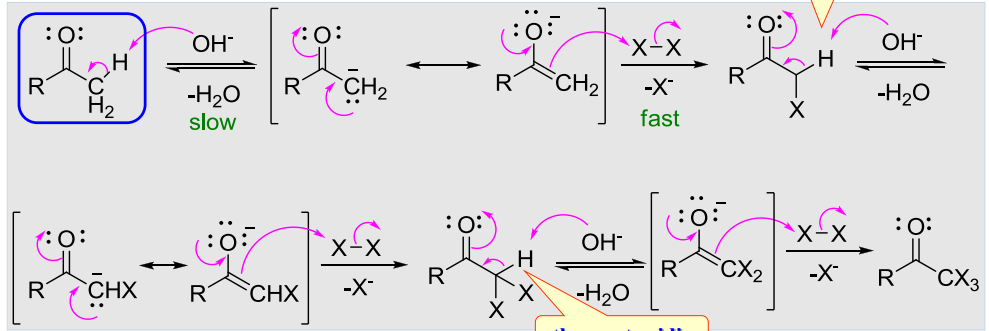
由于碱催化过程主要依赖于α-氢的酸性,而随着卤素取代数的增加,α-氢的酸性加强,使得碱催化的反应更容易发生,所以碱催化反应非常容易形成多取代产物,这是和酸催化反应截然不同的结果。
同时我们应该认识到,氢氧根本身不仅是一个碱性物质,其也有很强的亲核性,当多取代产物形成的时候,羰基碳上的正电务必强悍,氢氧根会进攻这个碳基,发生亲核加成-消除反应:
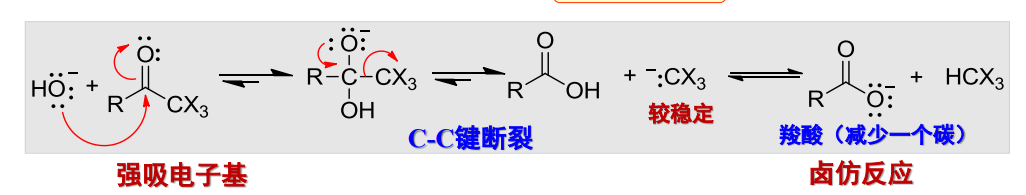
这就是卤仿反应,反应物主要为甲基酮与乙醛。
以下举出一个碘仿反应:
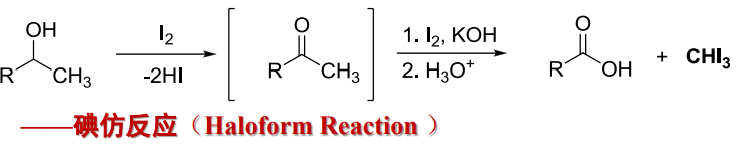
\(\ce{CH3I}\)是难溶于水淡黄色晶体,有特殊气味,容易识别。可用于鉴别乙醛和甲基酮。
特别地,以上举出的反应中,仅从第二步开始为碘仿反应,前一步的反应是含有\(\ce{CH3CH(OH) -}\)的仲醇可以被次卤酸钠氧化为甲基酮。
综上,卤仿反应条件包括有:\(\ce{X2/NaOH、NaOX、X2/OH-}\)
*12.2.2 醛的α-卤化反应
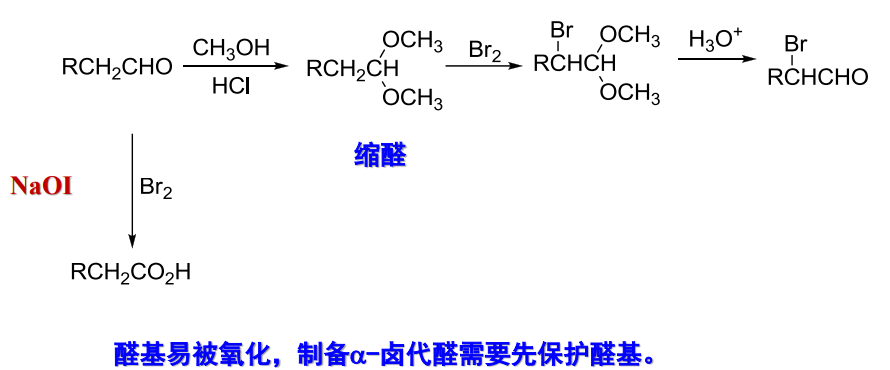
醛基易被氧化,制备α-卤代醛需要先保护醛基。
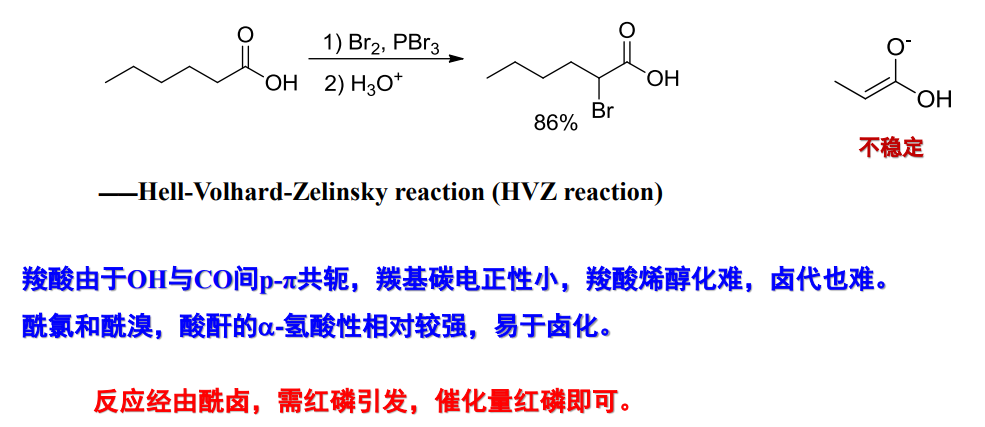
12.2.3 羧酸及其衍生物的α-卤化反应
12.3 α-烷基化反应
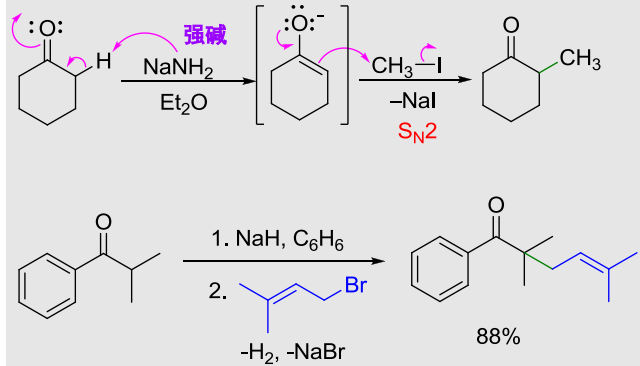
12.3.1 经由烯醇负离子的烷基化反应
该反应主要发生在碱性强,亲核性弱的试剂上:\(\ce{NaH, ^tBuONa, LDA, n-BuLi, NaNH2}\)。
反应举例与机理如下:
其中\(\ce{LDA}\)为:
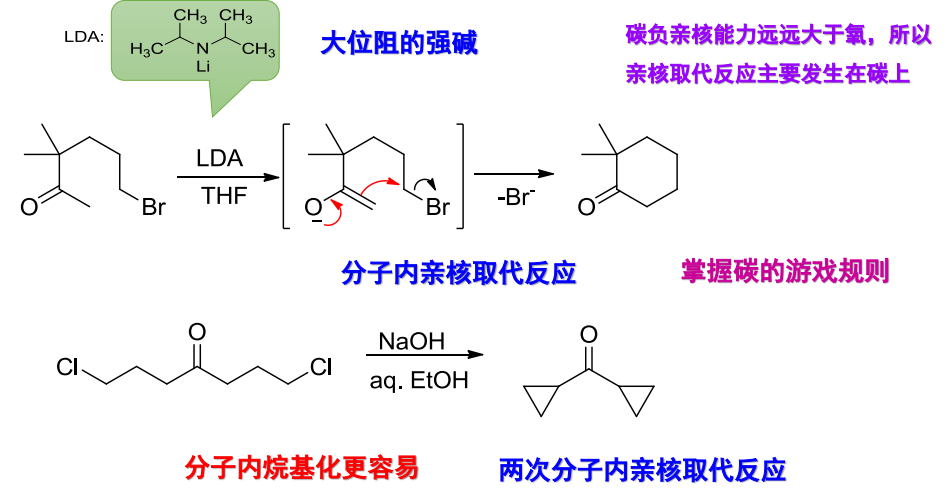
烷基化反应对于非对称酮具有区域选择性,烷基化位点一般在α-氢酸性较大的一侧:
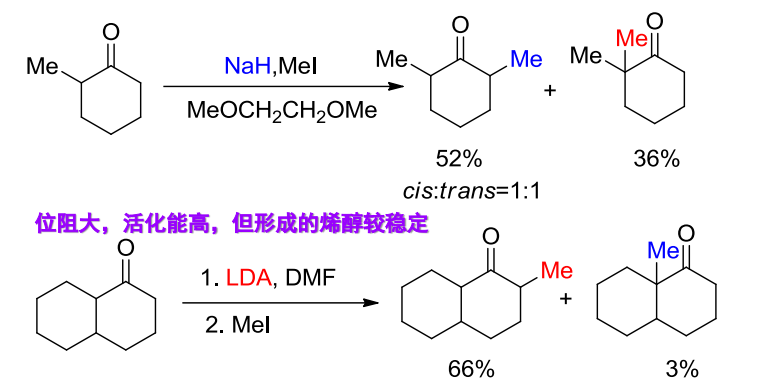
更加详细的解释可见下图:
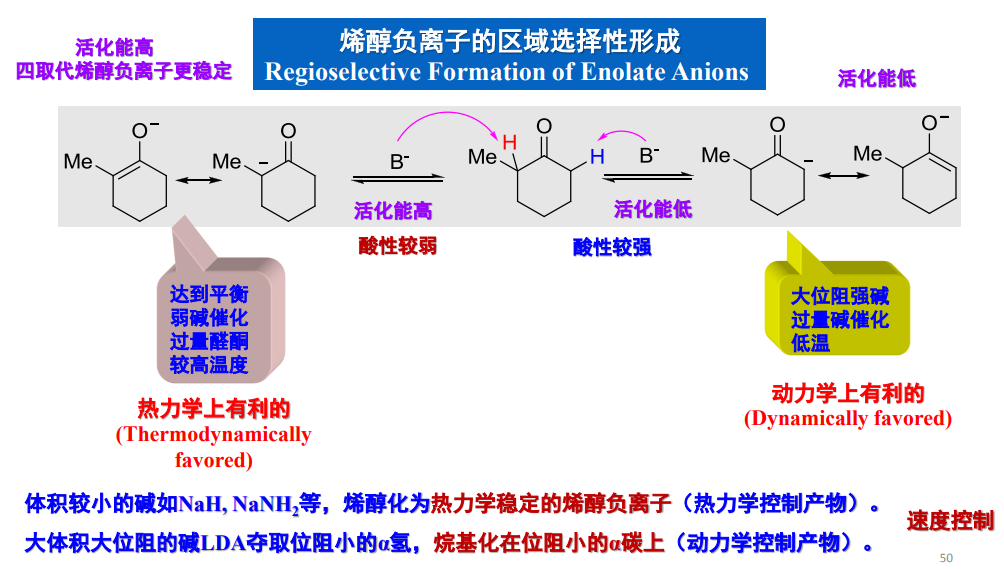
在大位阻强碱催化且低温的情况下,动力学控制,烷基化位点一般在α-氢酸性较大的一侧。在弱碱催化,较高温度且反应物过量时,热力学控制,倾向于选择有更加稳定的烯醇负离子中间体的反应途径。
如何提高区域选择性?
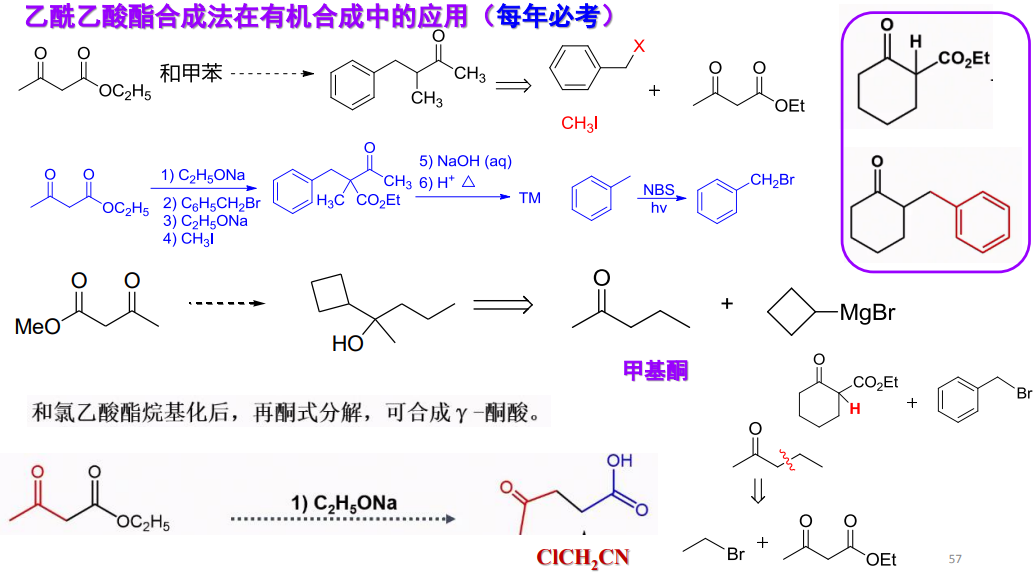
12.3.1.1 乙酰乙酸酯类合成法
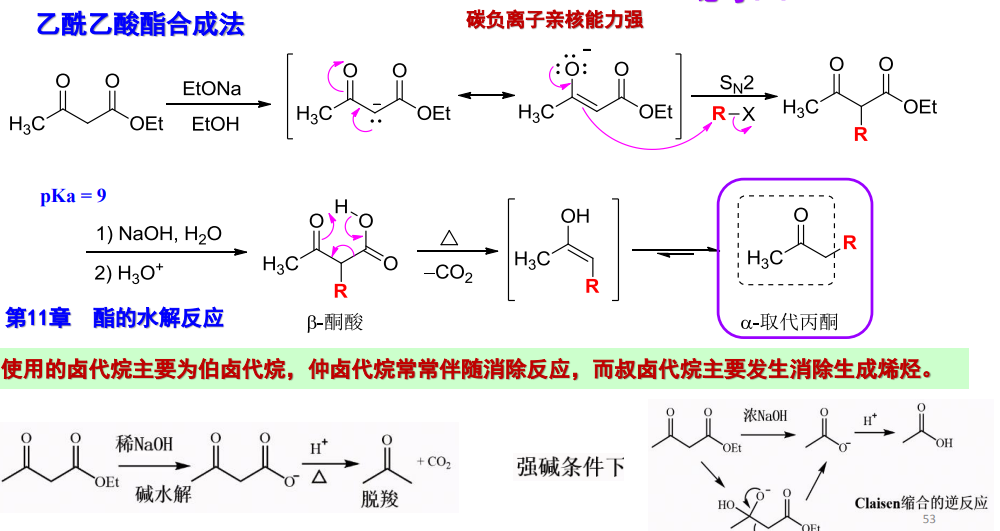
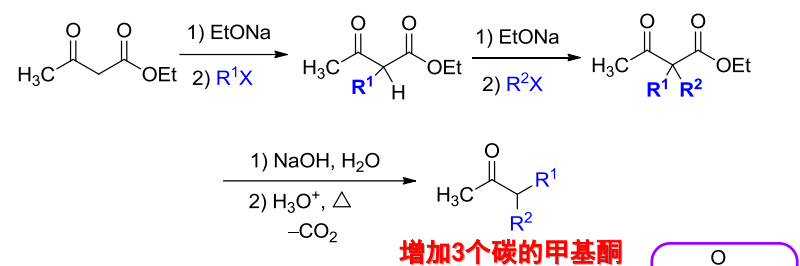
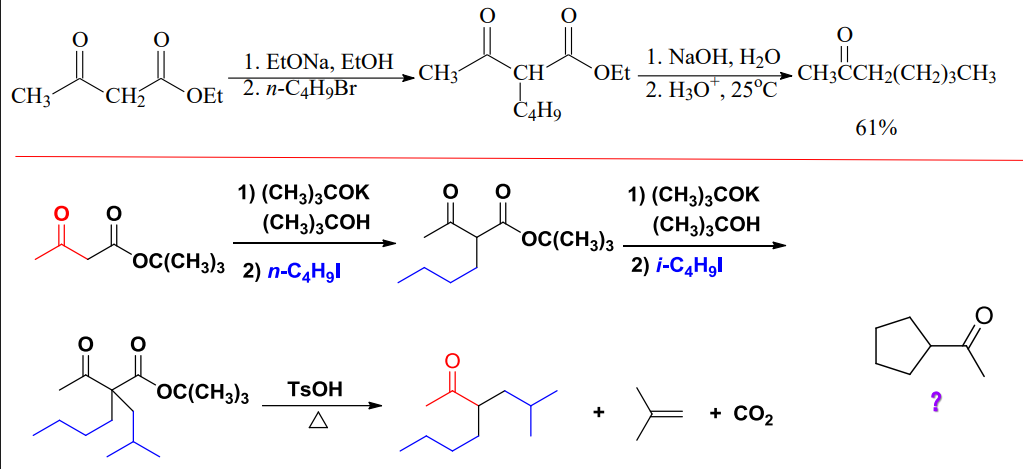
在乙酰乙酸酯类合成中,经历了脱羧反应,其更多应用如下:
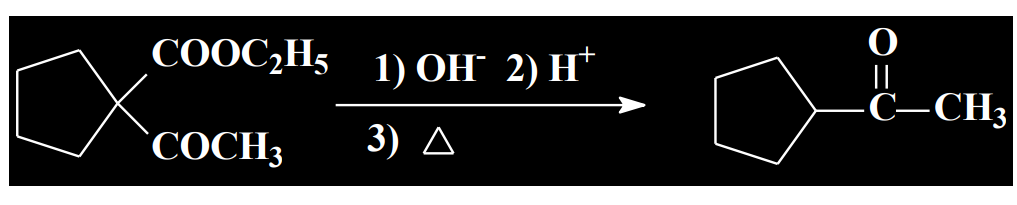
举出几个往年例题:
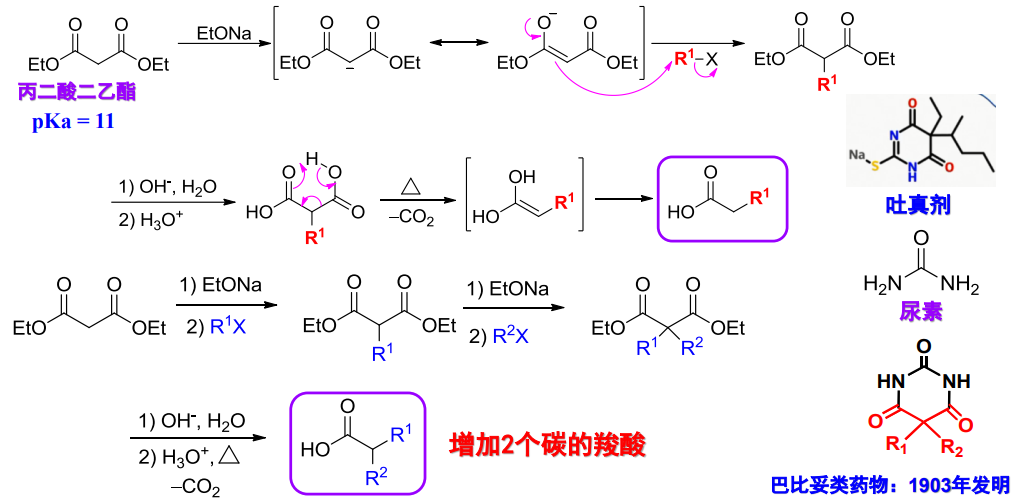
12.3.1.2 丙二酸酯类合成法
丙二酸酯类合成法与乙酰乙酸酯类合成法比较类似,如下;
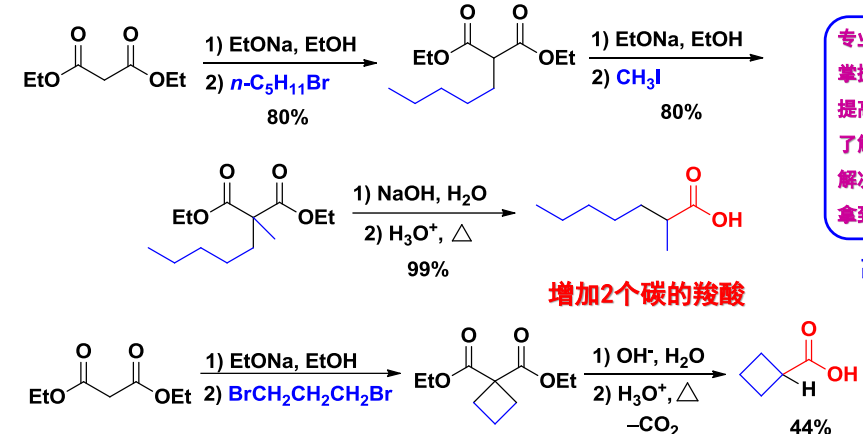
12.3.1.3 另附
12.3.2 经由烯胺的烷基化反应
此事已在第十章中有所记载,羰基与仲胺加成,形成烯胺,之后发生烷基化反应:
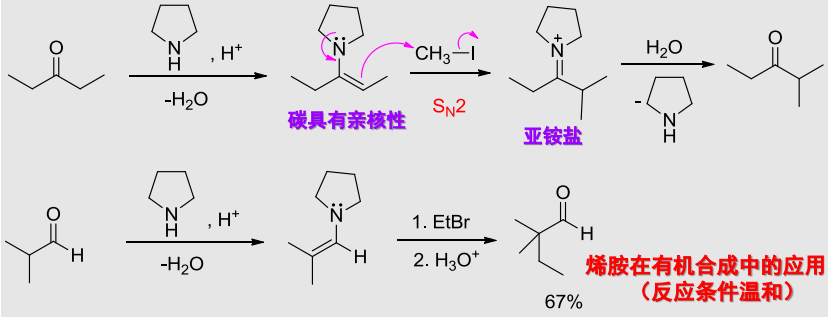
反应机理如下:
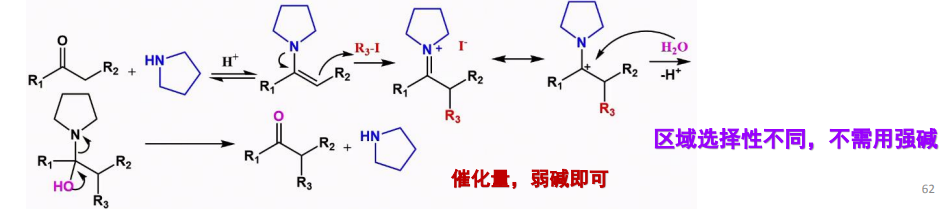
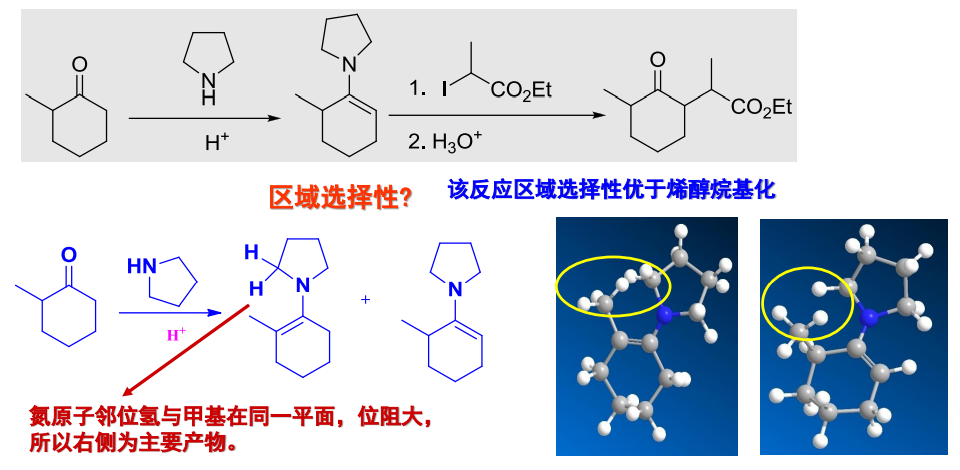
碳基两侧不对称时,形成双键的位置受限于仲胺与羰基之间的空间位阻因素,其区域选择性展示如下:
相对于经由烯醇负离子的烷基化反应,经由烯胺的烷基化反应的主要优点有;
- 条件温和
- 醛也可以反应
- 区域选择性高
- 不会发生多烷基化
12.4 羟醛缩合及其相关反应
12.4.1 羟醛缩合
羟醛缩合是一种亲核加成反应,其反应举例如下:
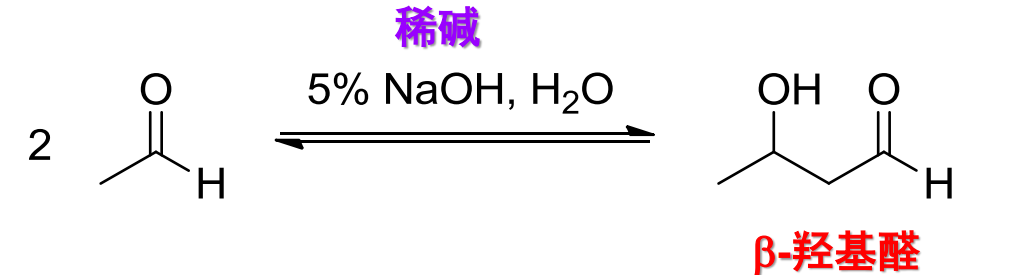
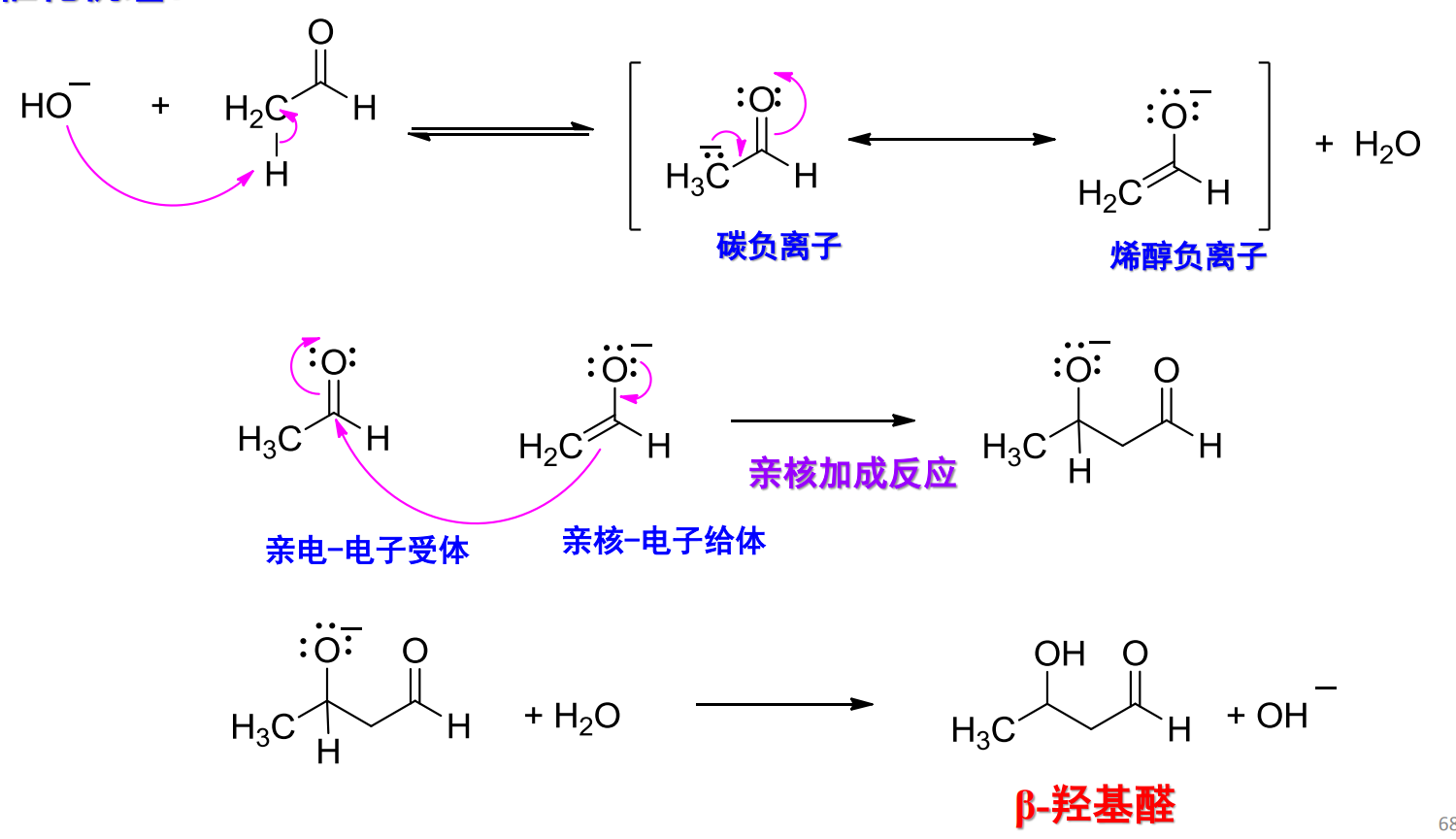
其反应中间物涉及到了烯醇,反应机理如下:
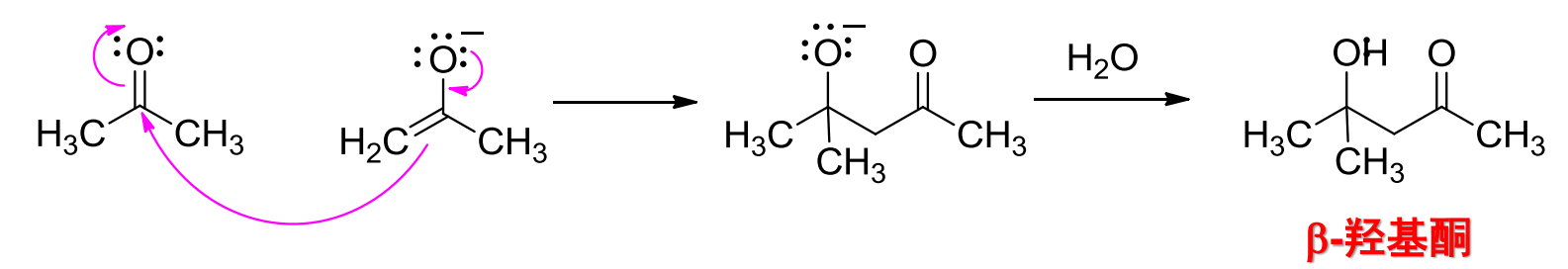
在稀碱催化下\(\ce{(5\%NaOH)}\),有α-氢的醛或酮可以发生羟醛缩合反应。
区别于康尼扎罗反应——无活泼α-氢醛在强碱作用下发生歧化,生成醛和酸的反应。
碱催化机理:
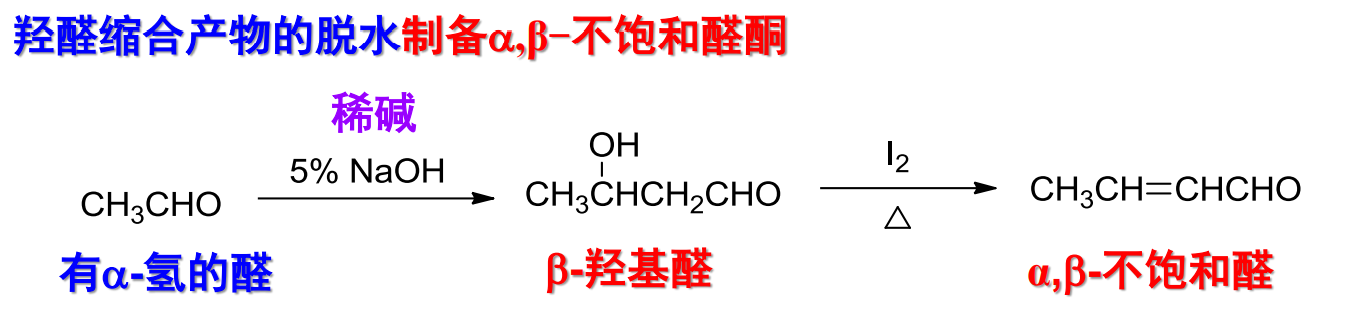
羟醛缩合生成的β-羟基醛容易脱水,生成α-β不饱和醛:
当然,有α-氢的醛或酮与没有α-氢的醛或酮可以发生交叉羟醛缩合反应。
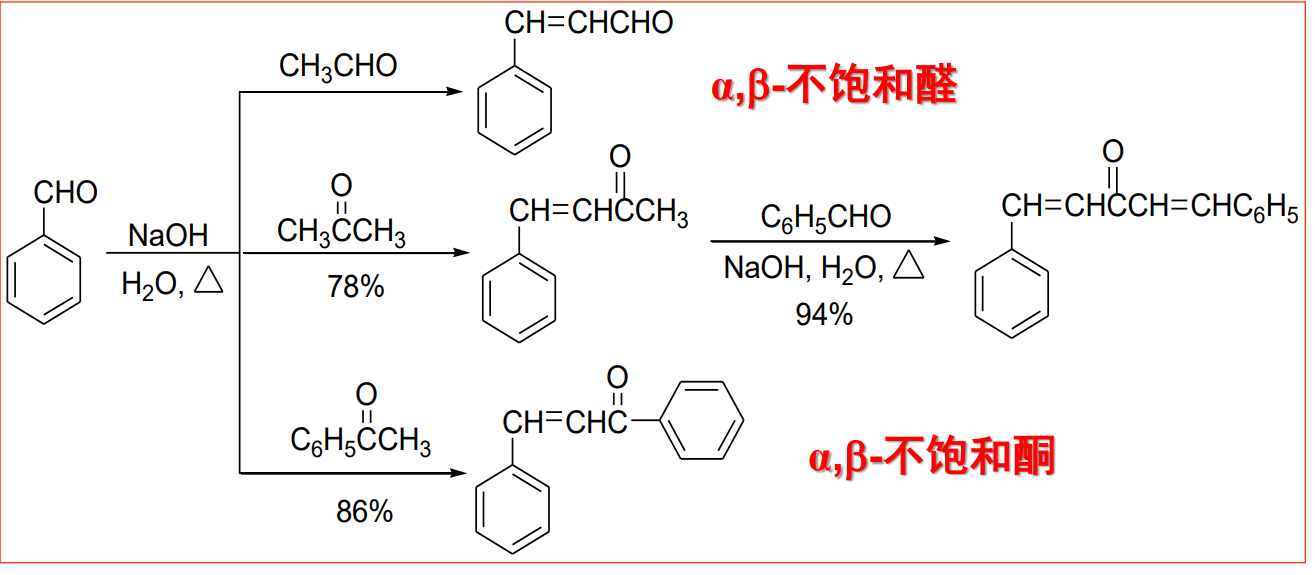
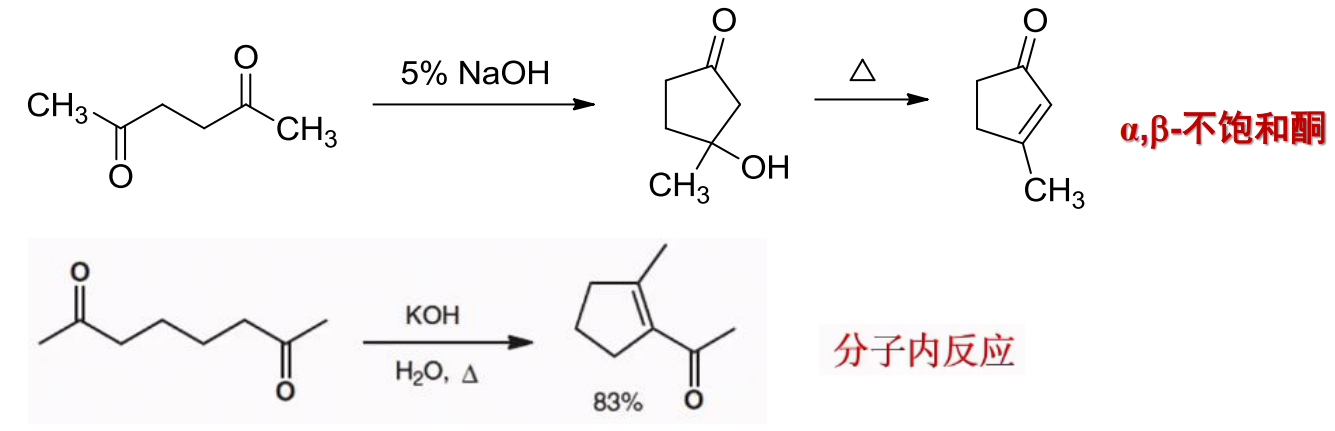
如果一个分子内含有两个合乎要求的羰基,同样可以发生分子内的羟醛缩合反应:
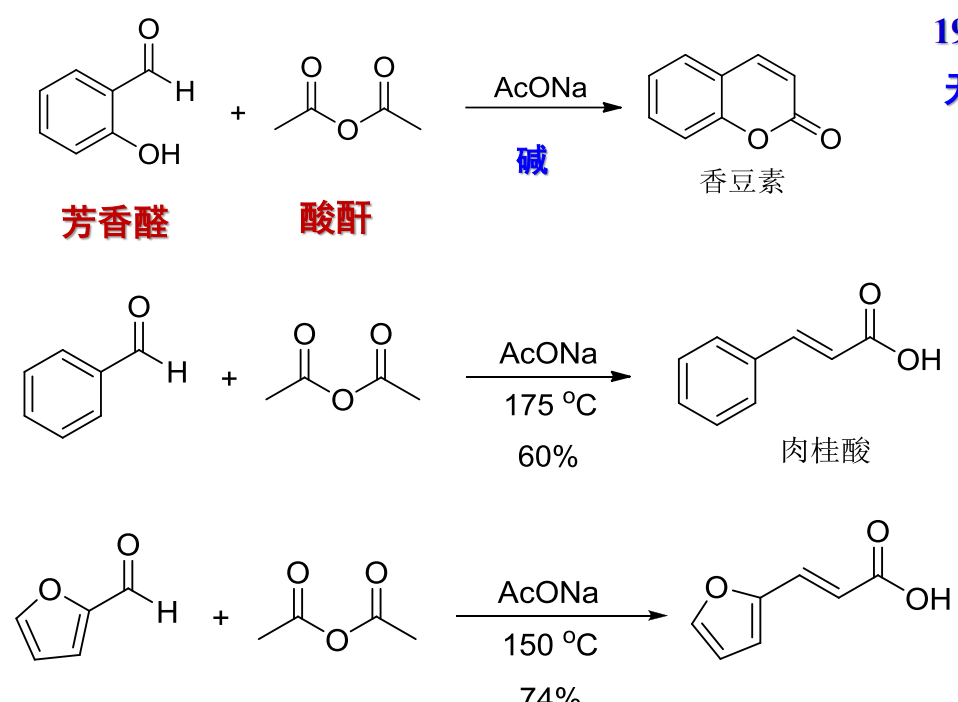
12.4.2 醋酸酐与芳香醛的缩合
借助芳香醛和酸酐(一般是醋酸酐),可以发生Perkin反应制备β-芳基-a,β-不饱和羧酸,反应举例如下:
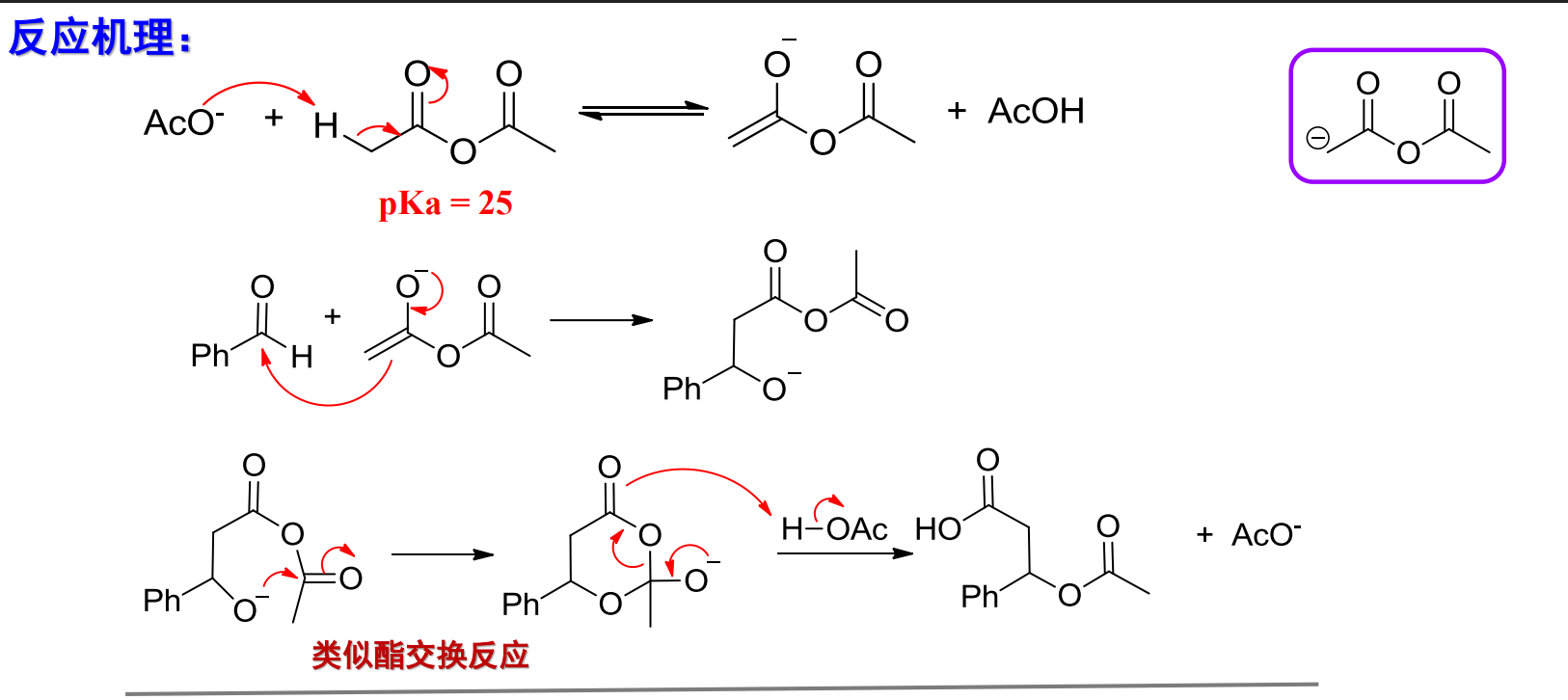
其反应机理如下:
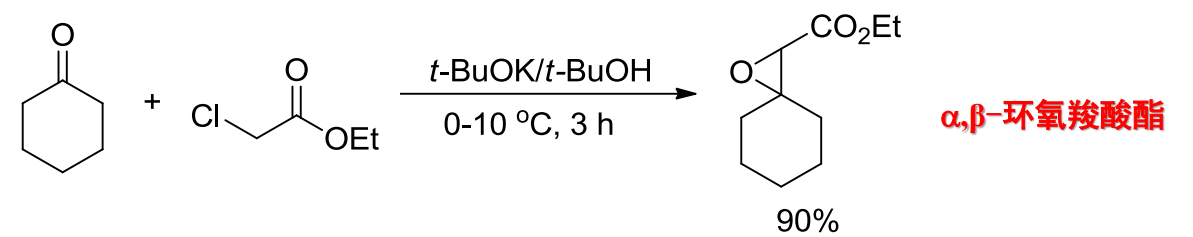
12.4.3 α-卤代羧酸酯的缩合反应
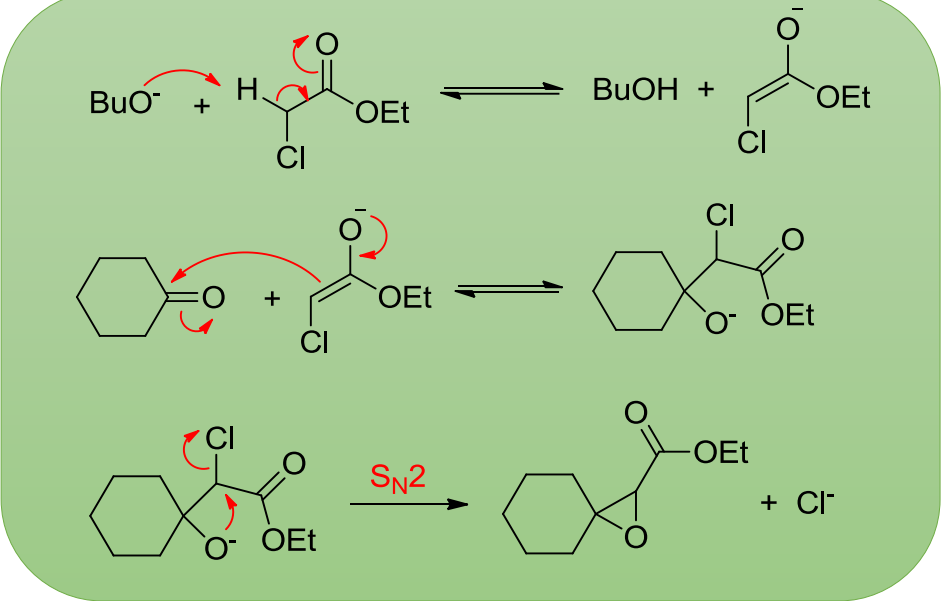
该反应也称为Darzen反应,生成环氧化物,反应举例如下:
反应机理如下:
12.5 酯缩合反应
12.5.1 Claisen缩合反应
在碱条件下,含有a-H的羧酸酯双分子缩合,生成β-酮酸酯,反应举例如下:
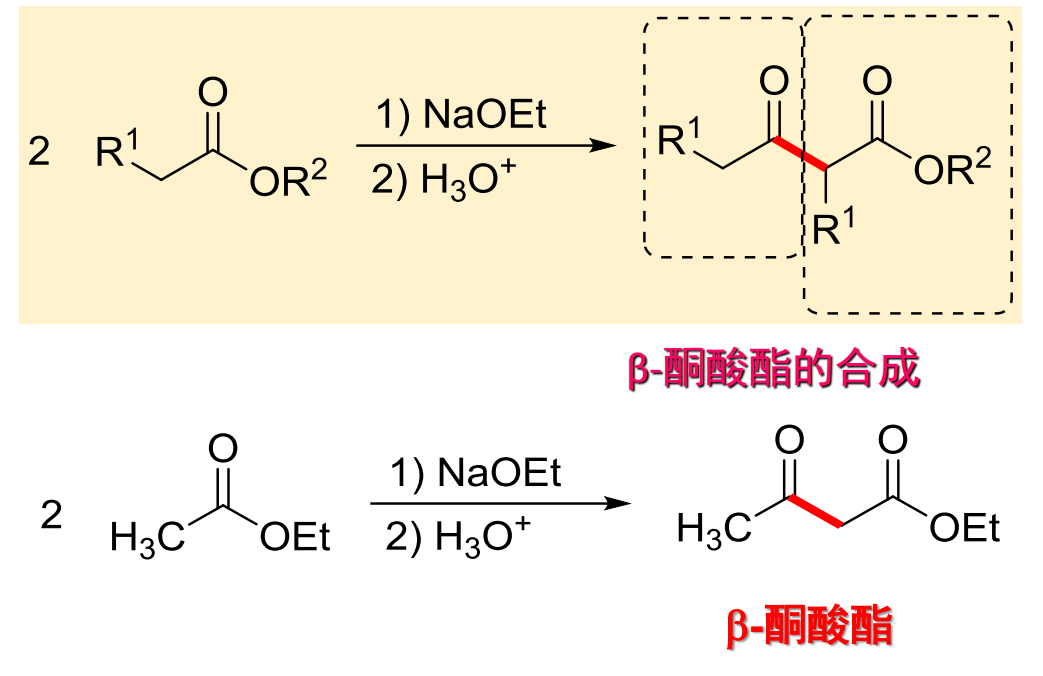
反应机理如下:

必须要有两个以上活泼氢才能发生Claisen缩合反应。
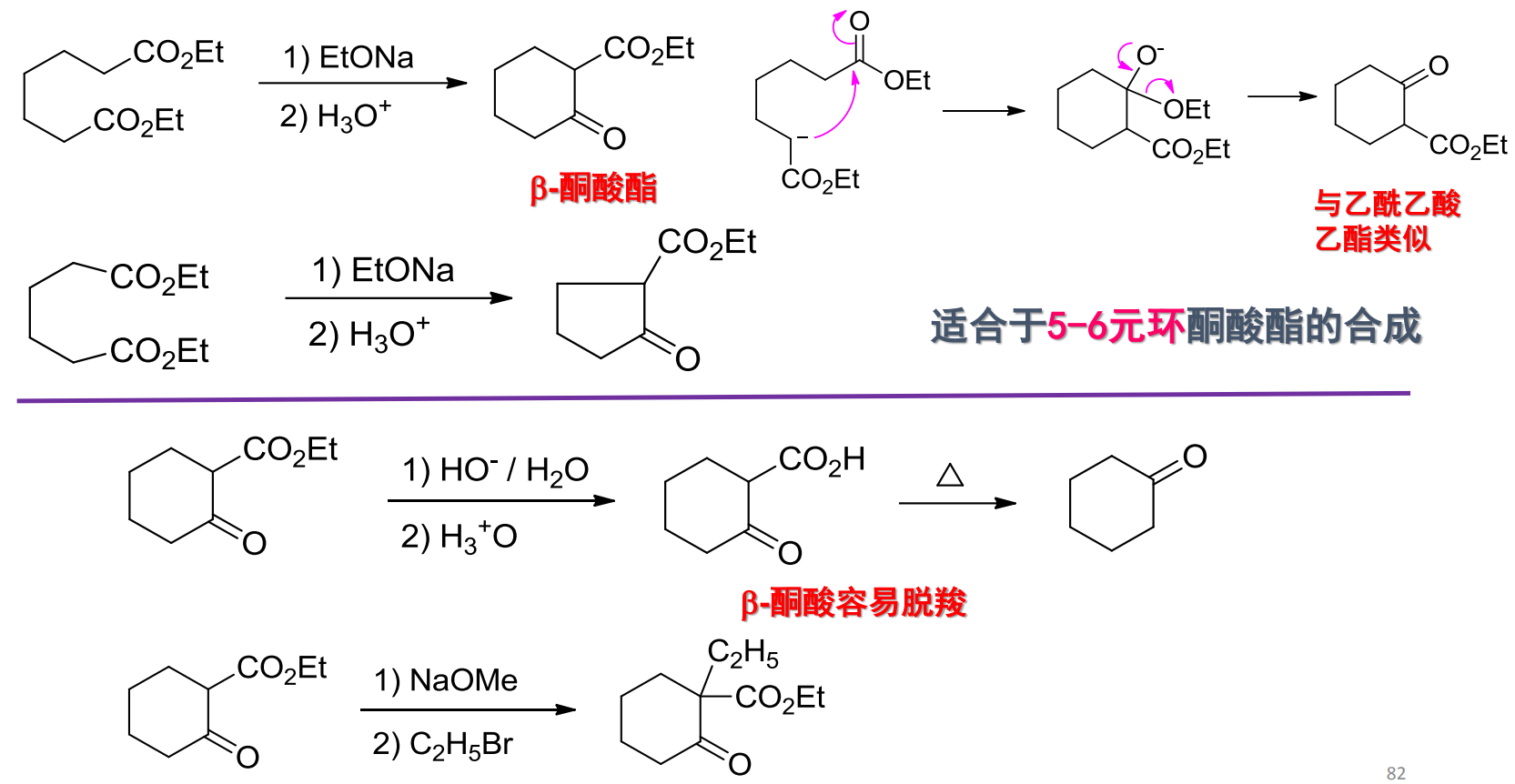
12.5.2 分子内的Claisen缩合——Dieckmann缩合反应
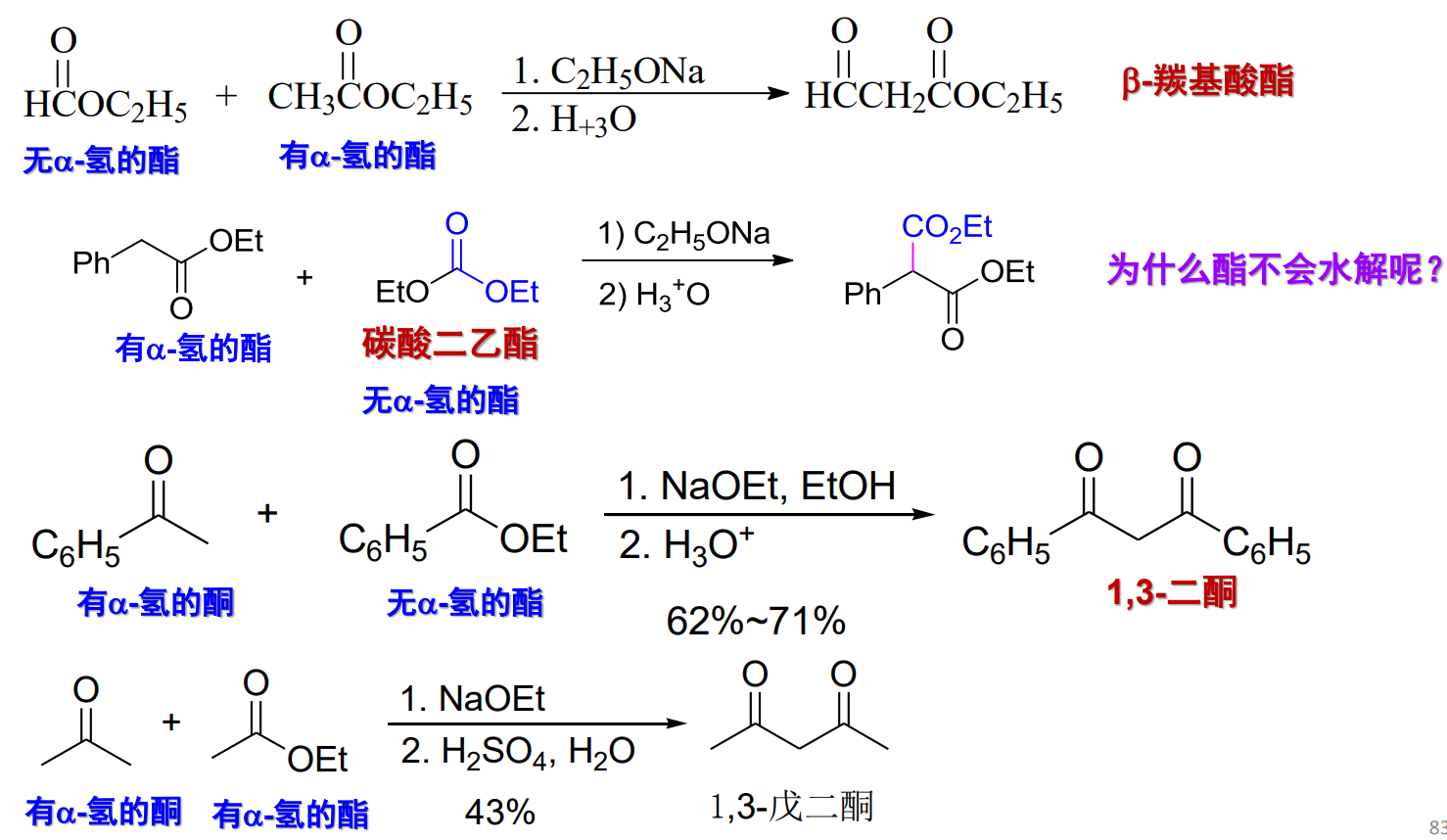
12.5.3 交叉酯缩合反应
12.6 Michael加成反应
Michael加成反应是发生在α,β-不饱和醛或酮上的共轭1,4-加成反应。
反应机理如下:
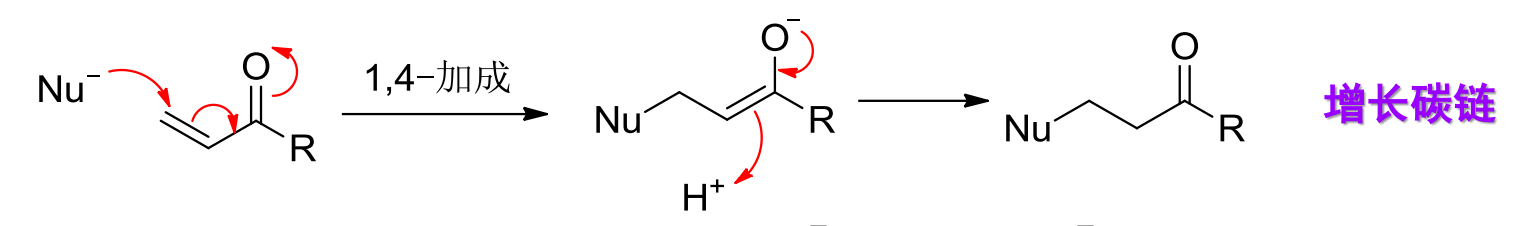
反应举例如下:
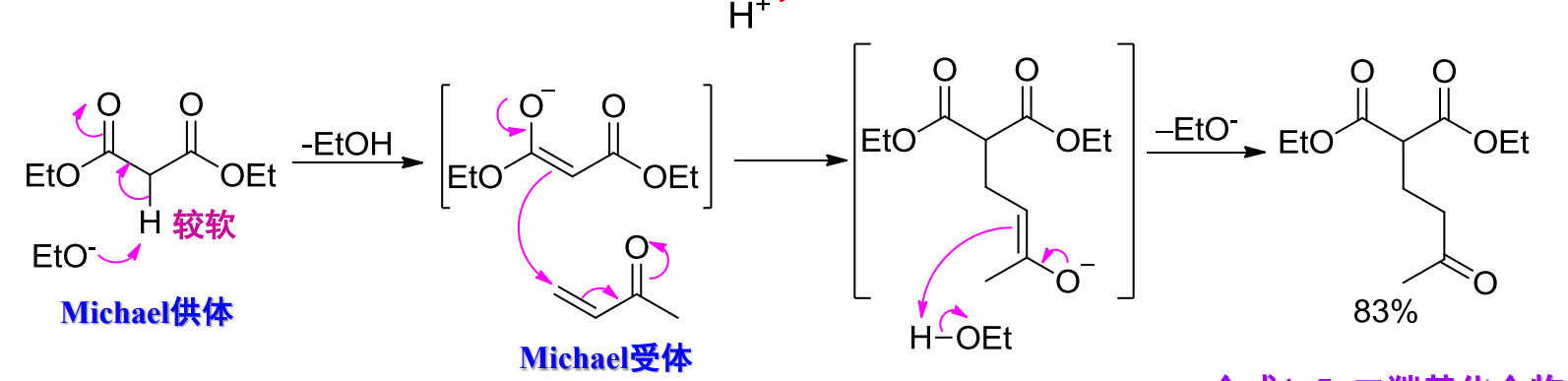
和各种亲核试剂(碳负离子,胺和\(\ce{R2CuLi}\))均发生1,4-加成,但与格式试剂发生1,2-加成。