第十三章 胺及其衍生物
13.1 胺的分类和命名
13.1.1 胺的分类
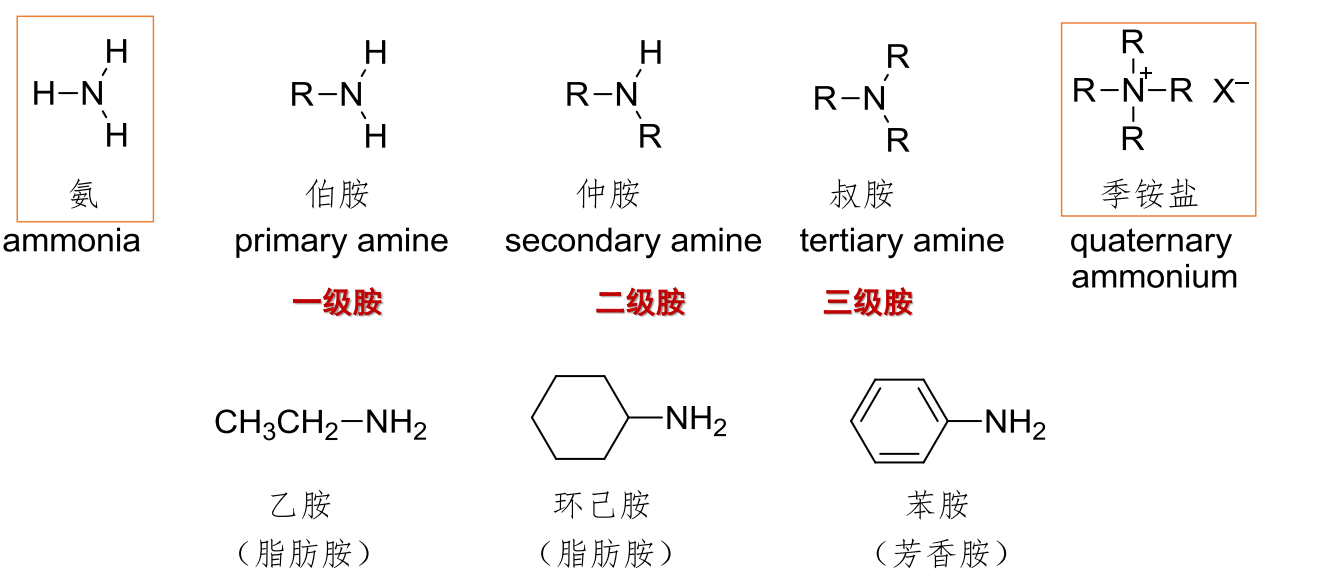
13.1.2 胺的命名
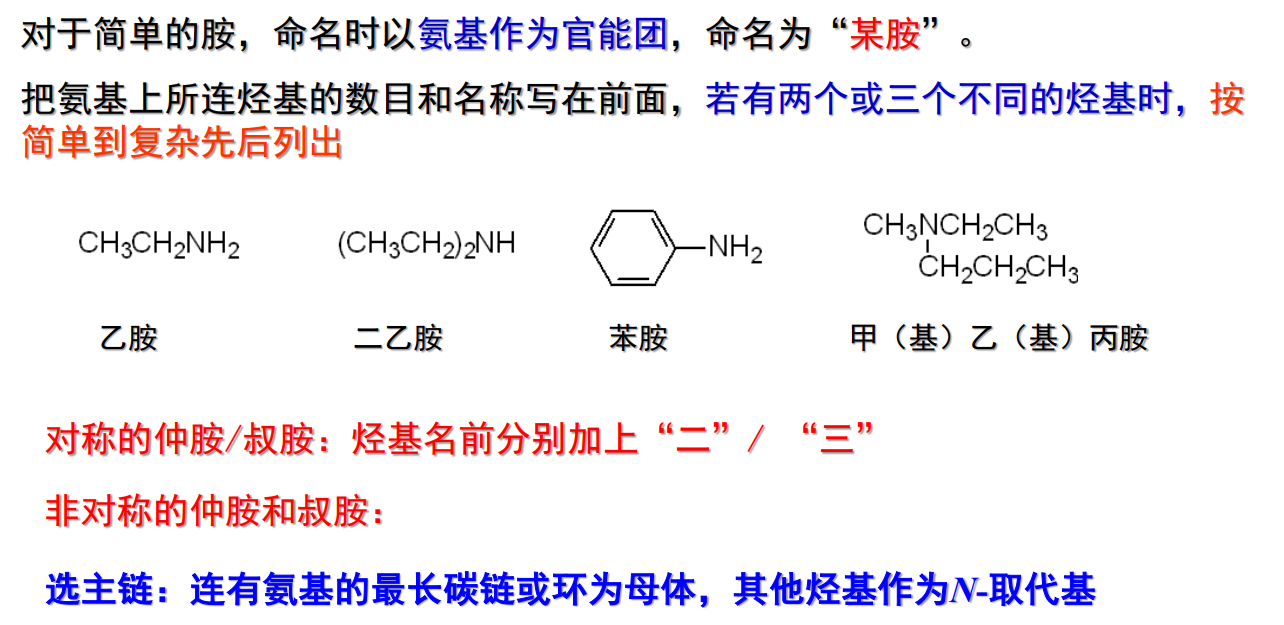
13.1.2.1 普通命名法
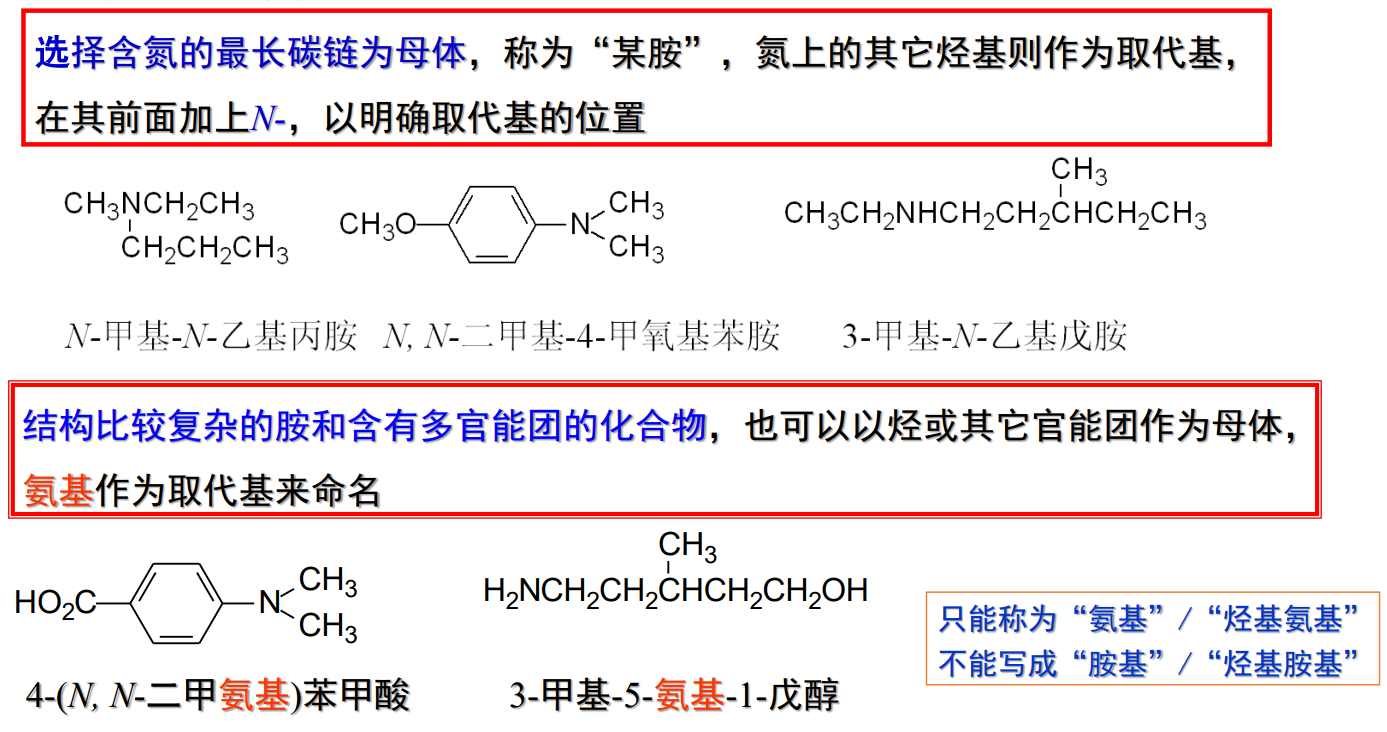
13.1.2.2 胺的UPAC命名
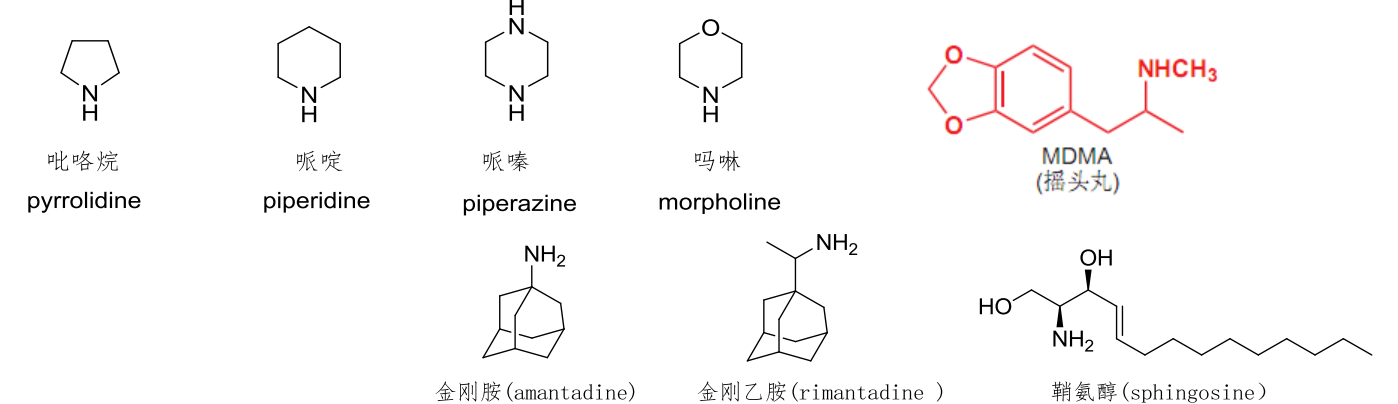
常见的环状胺如下:
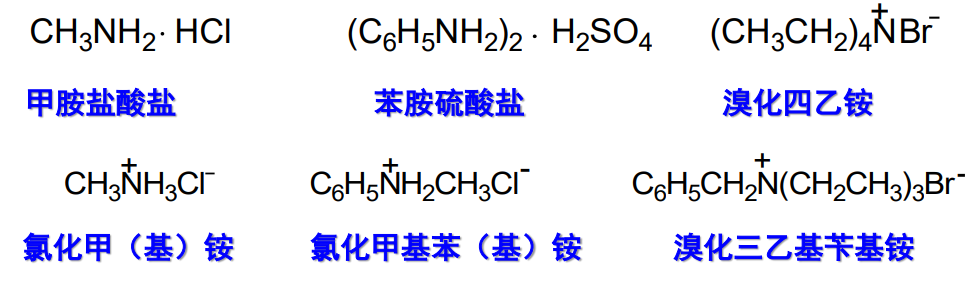
13.1.2.3 铵盐或季铵盐的命名
13.1.4 胺的结构
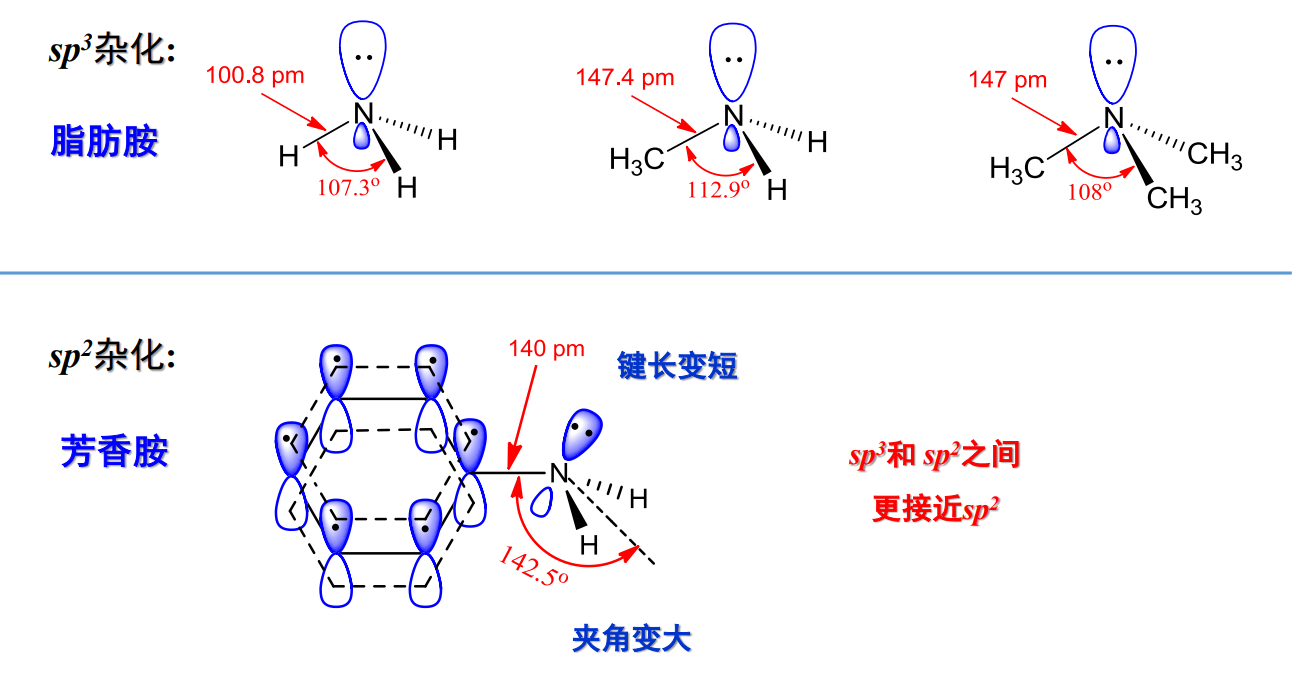
芳香胺中,氮上孤对电子与苯环大派键有轻微的p-π共轭,使得其杂化介于\(sp^2\)和\(sp^3\)之间。
胺也有手性:
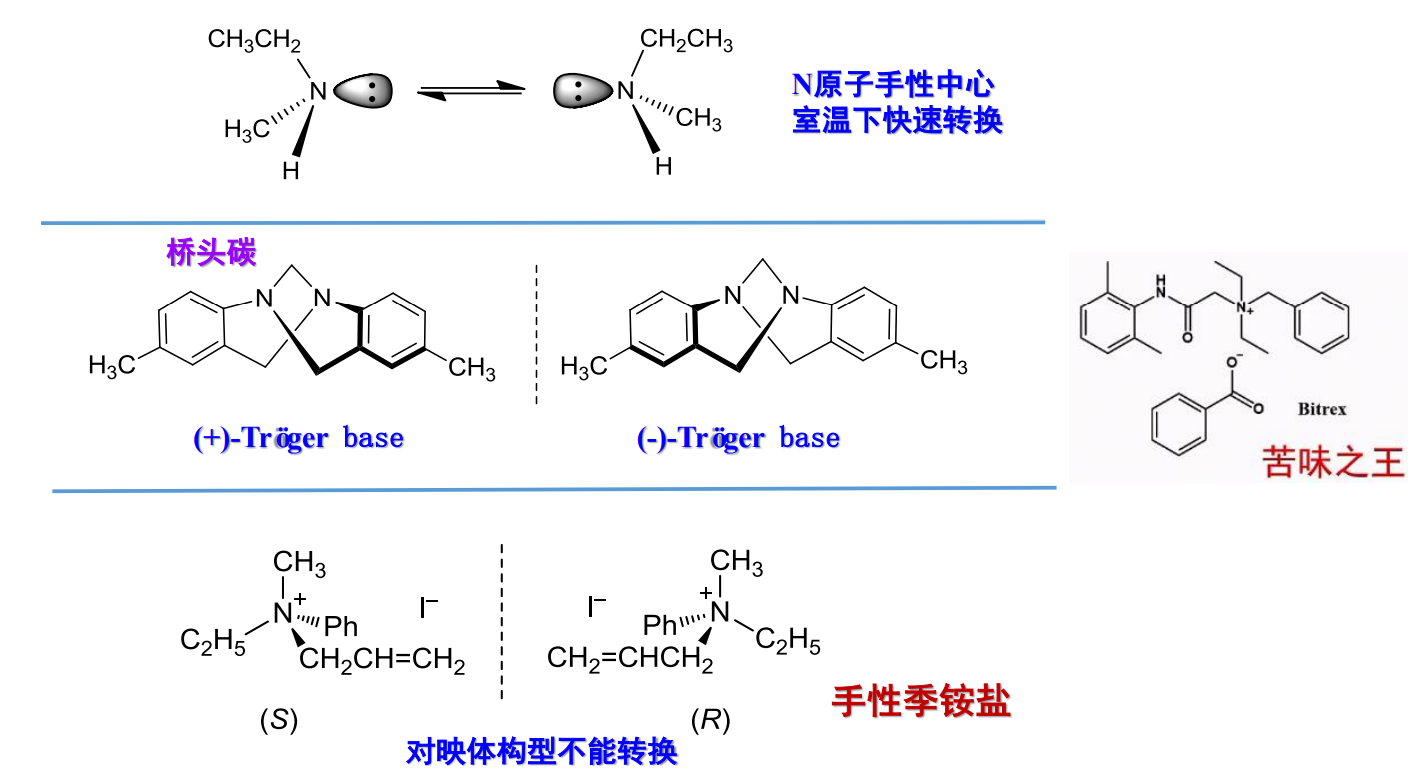
但是单独的手性\(\ce{N}\),其构型容易反转,呈现外消旋体的状态。
如果胺成环,不容易翻转,则容易得到有手性的化合物,季铵盐也容易分离出有手性的化合物。
13.2 胺的物理性质
13.2.1 熔点、沸点和溶解度
- 沸点:氮上氢也可以形成氢键,但是弱于氧上的氢,所以比等相对分子量的醇弱。
- 溶解度:分子量低的胺可溶于水,芳香胺一般难溶于水。
13.3 胺的碱性和酸性
13.3.1 胺的碱性
胺中氮原子上的孤对电子能够接受质子而显碱性,胺能进攻缺电子中心而显亲核性。
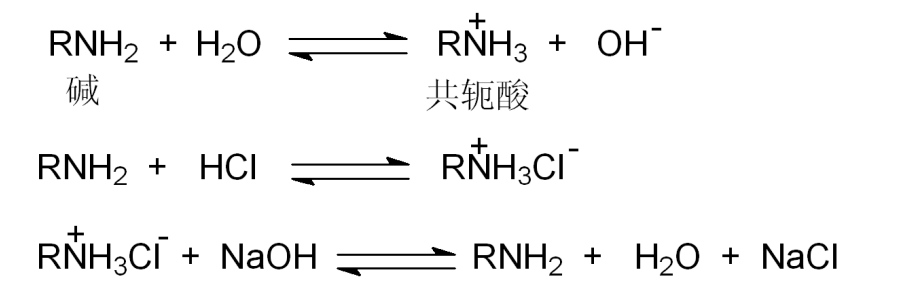
胺的碱性通常用它的共轭酸(即烃基取代的铵离子)的\(pK_a\)值大小来表示。
影响胺的碱性有如下几个因素:
- 氮原子杂化类型:
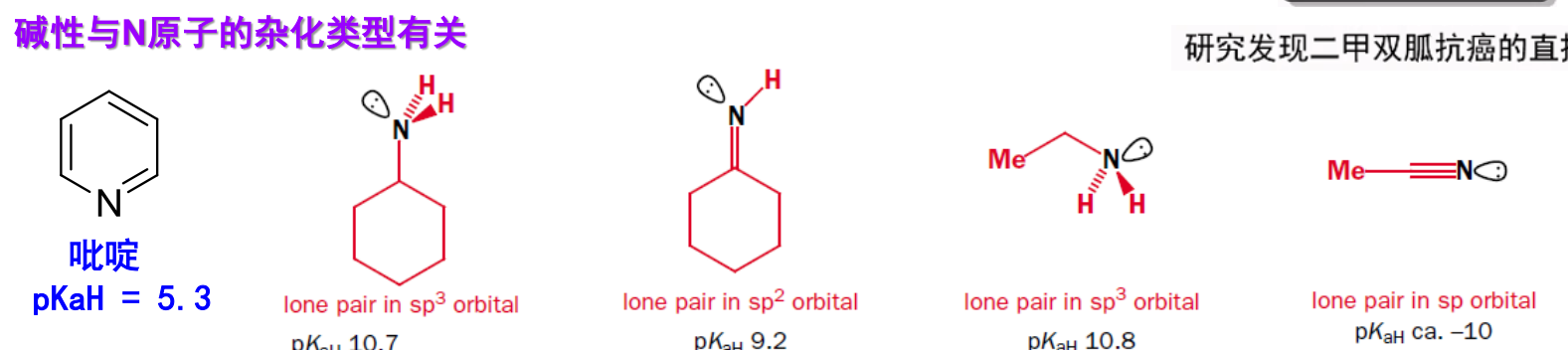
- 氮原子周围电子云密度:氮原子周围电子云密度越高,接受\(\ce{H+}\)的能力越强,碱性越强。同理,其共轭酸酸性越弱,越稳定,其碱性越强。
- 水的溶剂化作用:胺上氮的氢原子越多,溶剂化程度越大,铵正离子就越稳定,碱性就越强。(形成氢键)
所以我们需要考虑烷基的给电子作用、氢键的溶剂化作用,以及氮原子杂化状态(电子效应)三个因素的综合作用,得出以下胺的相对碱性大小:

特别地,如果氮上连有吸电子基,则使得氮上正电荷更集中,铵离子稳定性降低,使得胺的碱性降低。
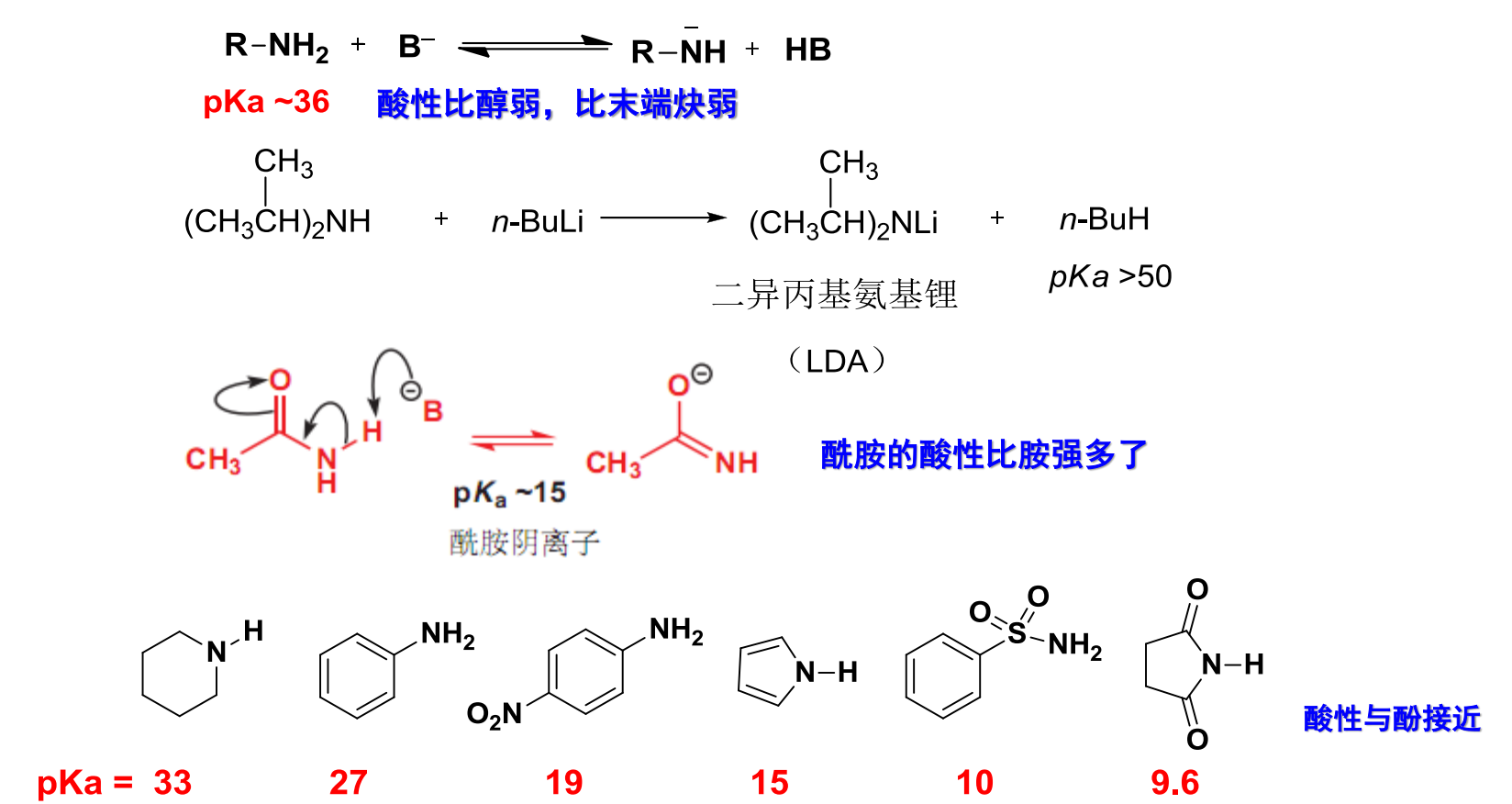
13.3.2 胺的酸性
13.4 胺的制备
13.4.1 氨和胺的烃基化
其本质是遵循亲和取代反应:
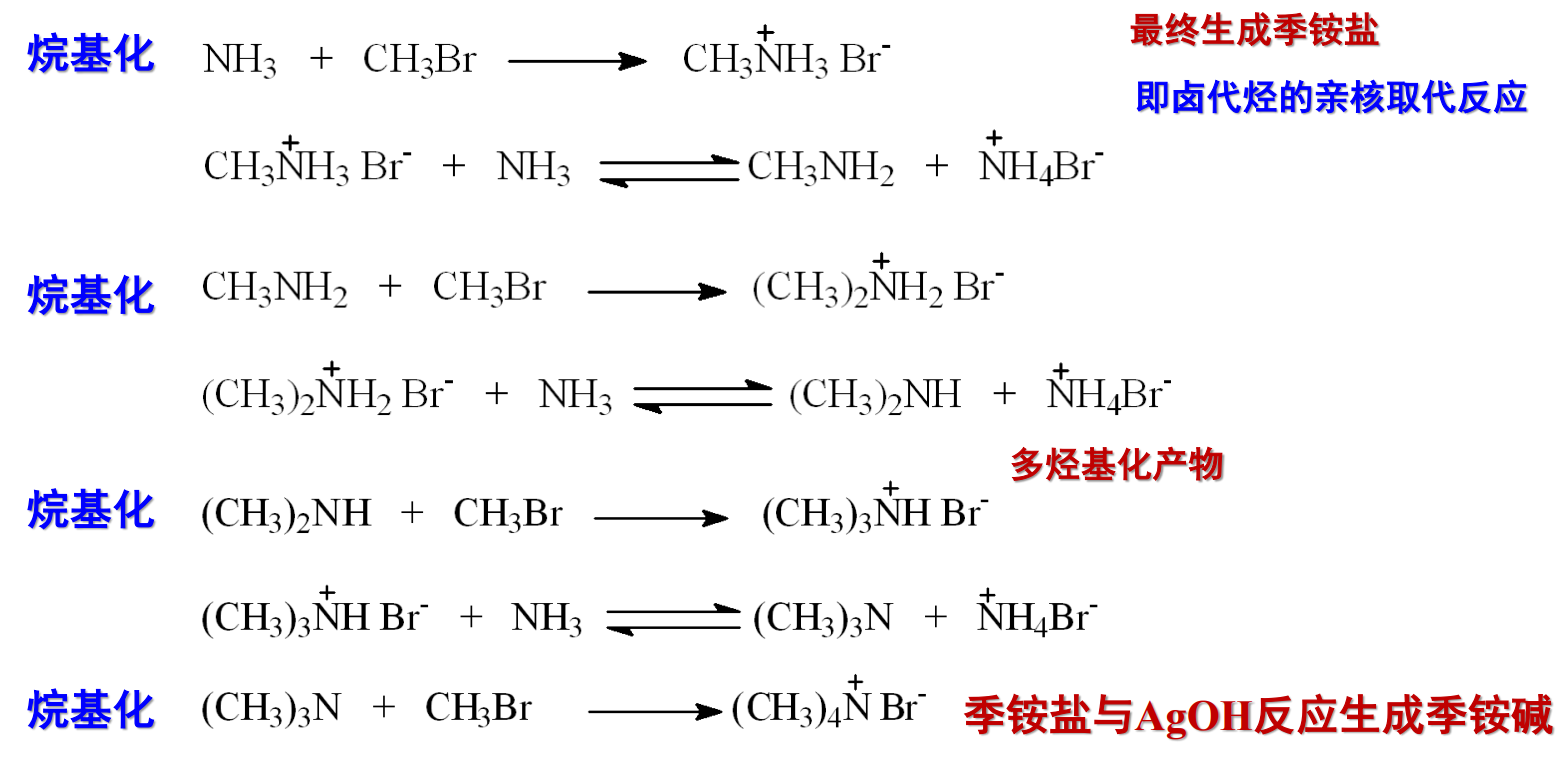
由上举例了氨与胺的烃基化,反应条件得当可以发生多烃基化反应。
以下展示几个反应实例:
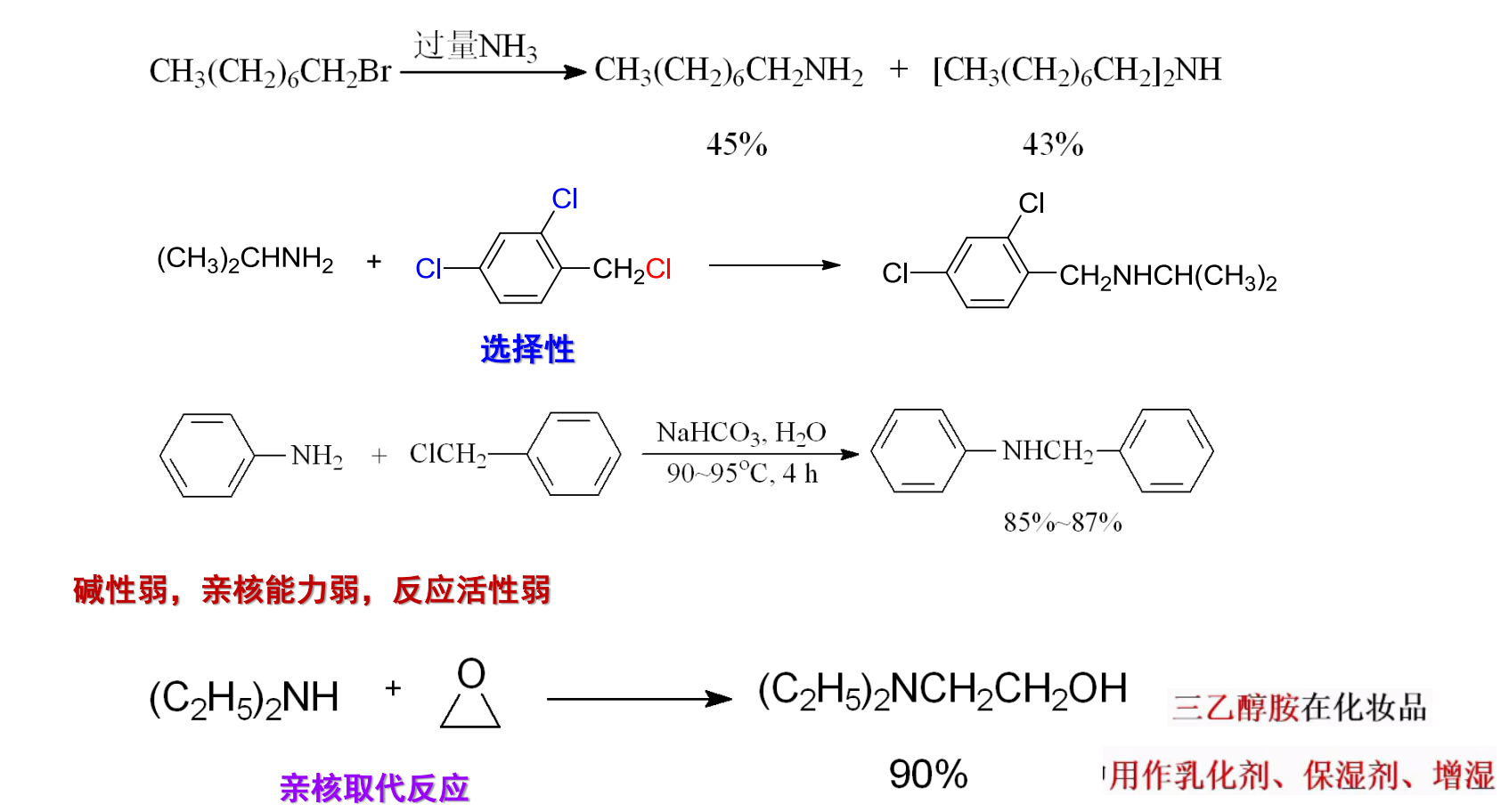
注意最后反应,其是一个经典的,得到增长两个碳原子的醇的反应。
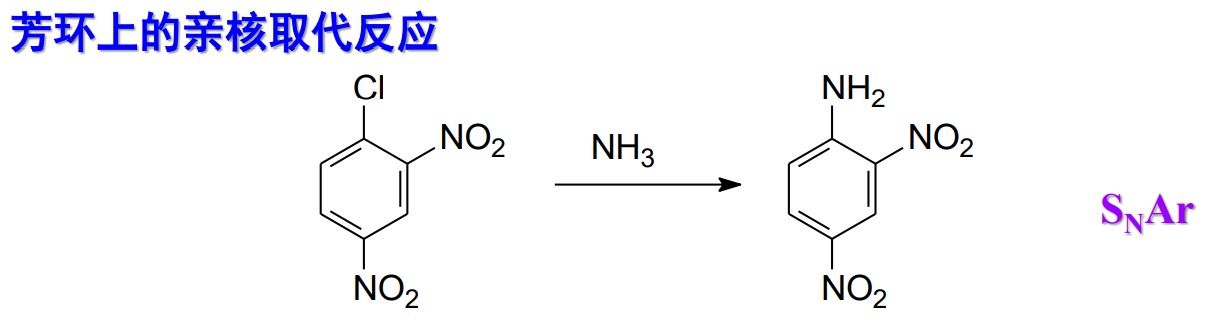
补充芳环上的亲核取代反应\(\ce{S_NAr}\):
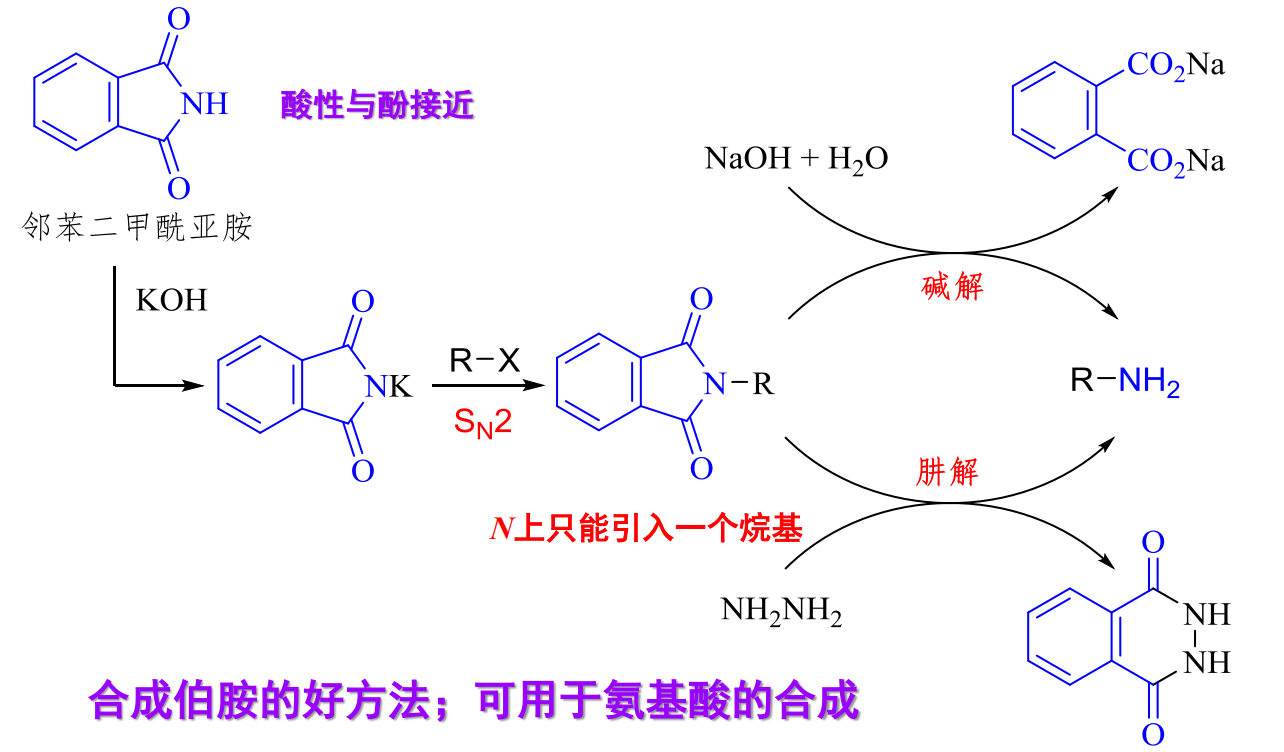
13.4.2 Gabriel合成法
该反应目的是合成伯胺,途径为以邻苯二甲酰亚胺的钾盐为亲核试剂,与卤代烷进行烷基化反应,所得到的N-烷基邻苯二甲酰亚胺经水解或肼解得到伯胺。
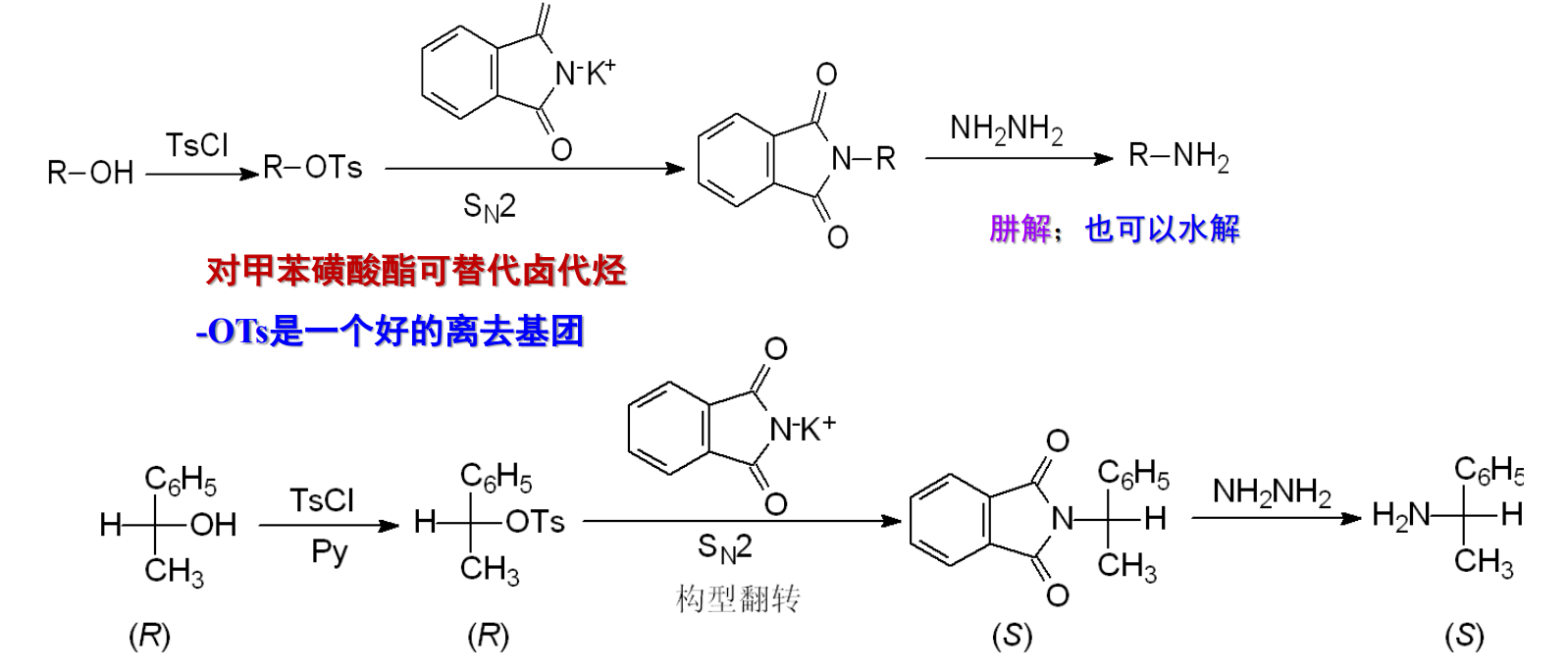
注意,中间亲核取代反应为\(\ce{S_N2}\)机理,会出现构型翻转。
特别地,酰胺不容易水解,所以最后步骤需要采用强碱。
具体的应用如下:
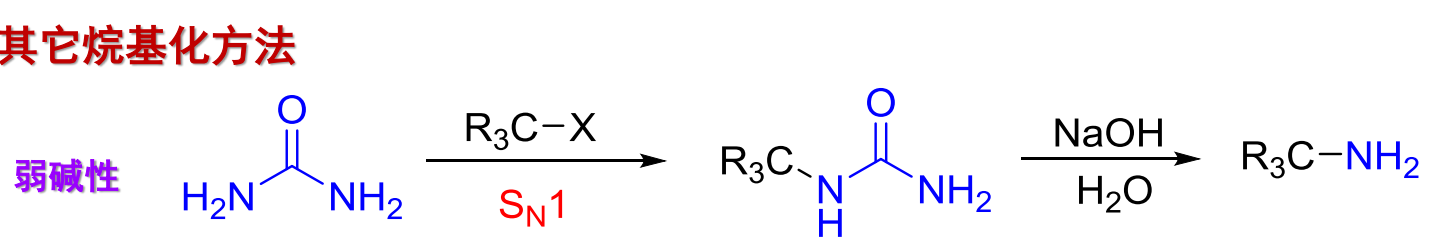
另外有\(\ce{S_N1}\)机理的制备反应,采用弱碱性试剂:
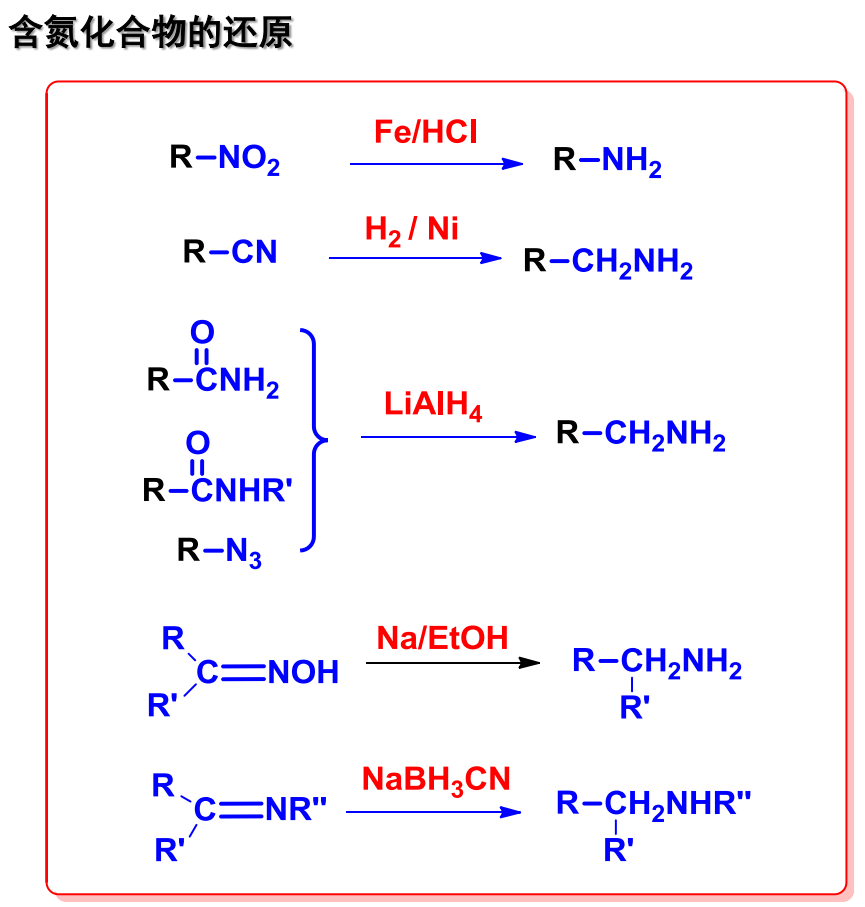
13.4.3 含氮化合物的还原
含氮化合物包含有硝基,氰基,酰胺,亚胺等等,下展示大部分含氮化合物的还原通式:
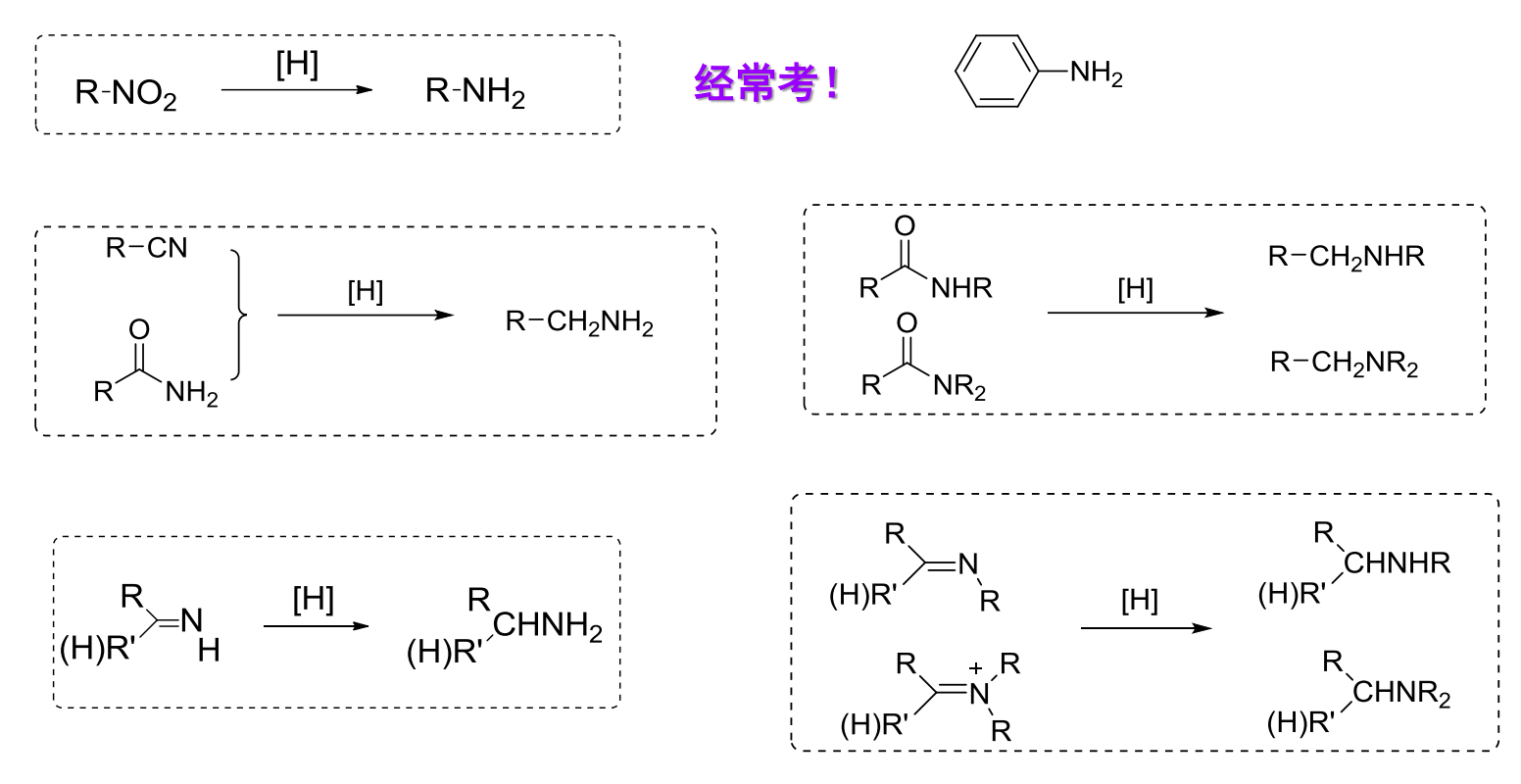
13.4.3.1 硝基化合物
硝基化合物常用的还原条件是\(\ce{Fe/HCl}\),后在碱性条件下生成对应的胺。
硝基化合物的还原也可以通过Clemmensen还原,其不仅可以还原醛酮,还可以还原硝基。
硝基化合物还原的净结果是生成氨基。
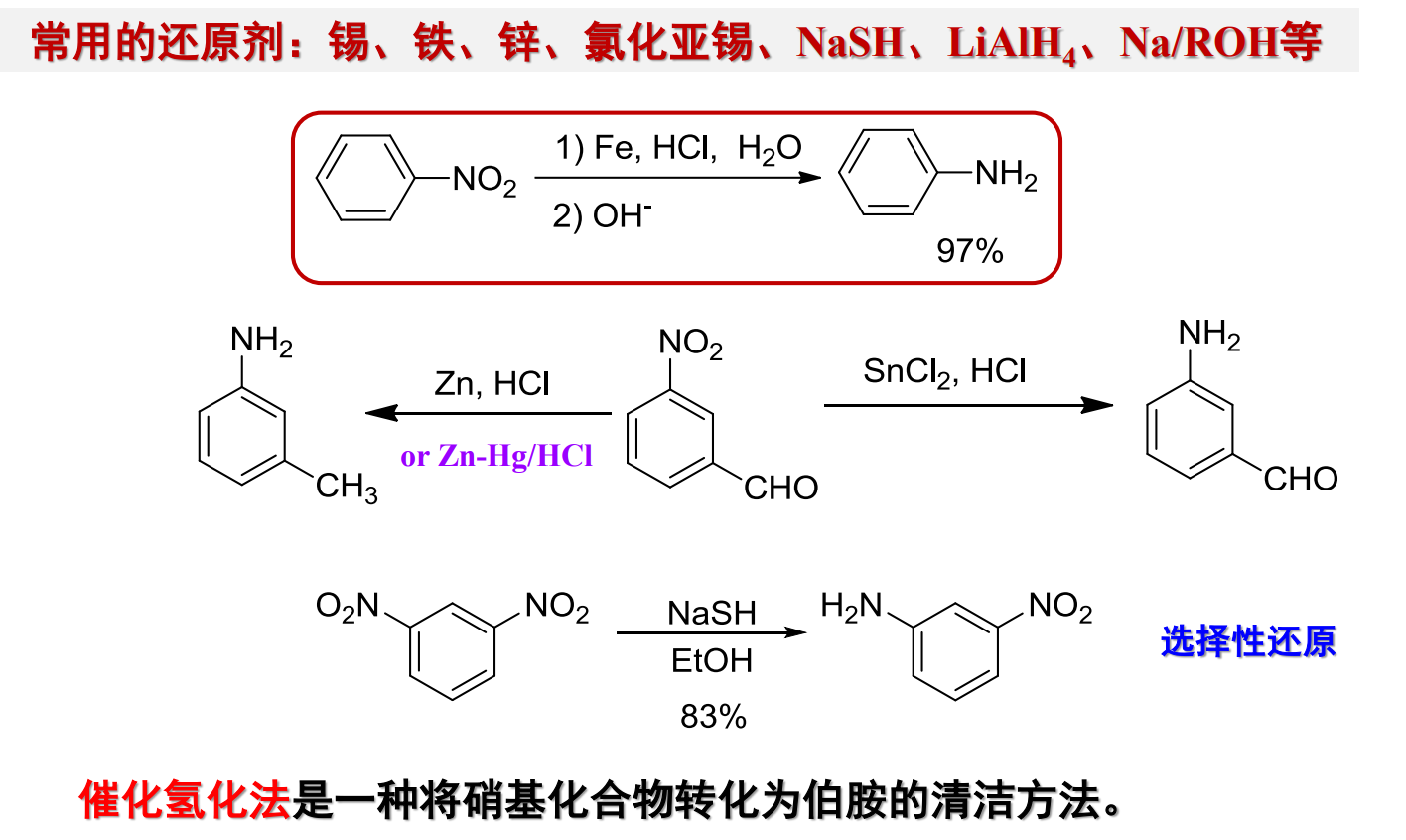
13.4.3.2 酰胺还原
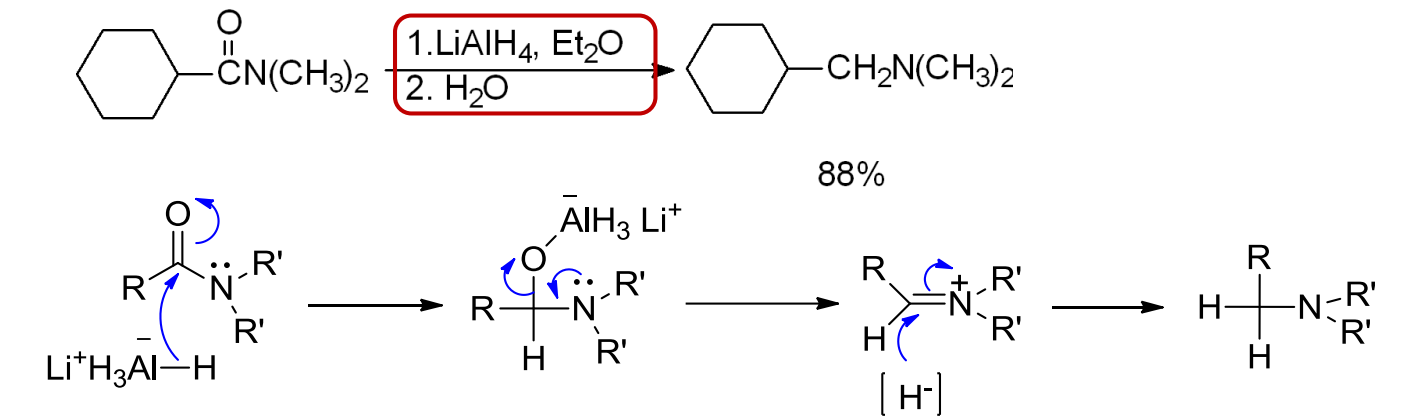
酰胺的还原可以通过氢化铝锂在无水乙醚下进行,碱性条件下生成还原产物。
酰胺还原的净结果是将羰基还原为亚甲基。
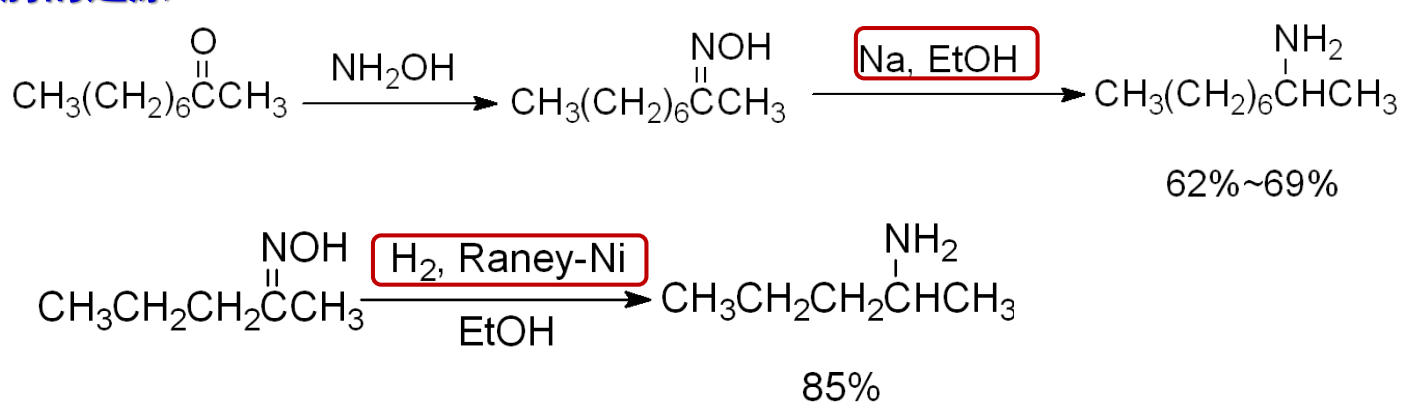
13.4.3.3 肟的还原
肟的生成涉及第十章的羟胺与羰基的反应,其在活泼碱金属与醇、催化氢化法两种条件下均可以被还原为对应的胺。
13.4.3.4 腈和叠氮化合物的还原
可以使用催化氢化,或者氢化铝锂来还原,净结果相当于碳氮三键两次加成。
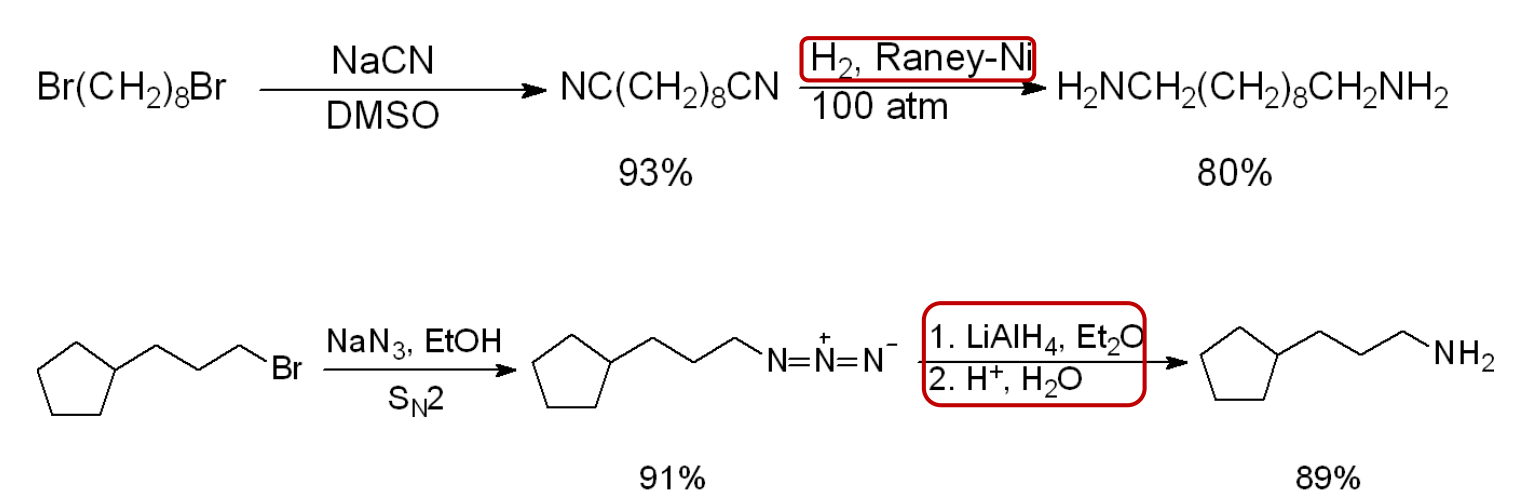
13.4.3.5 亚胺的还原
首先伯胺与醛酮反应生成亚胺,然后还原亚胺,得到对应的胺,净结果相当于醛酮的还原氨化,反应如下:
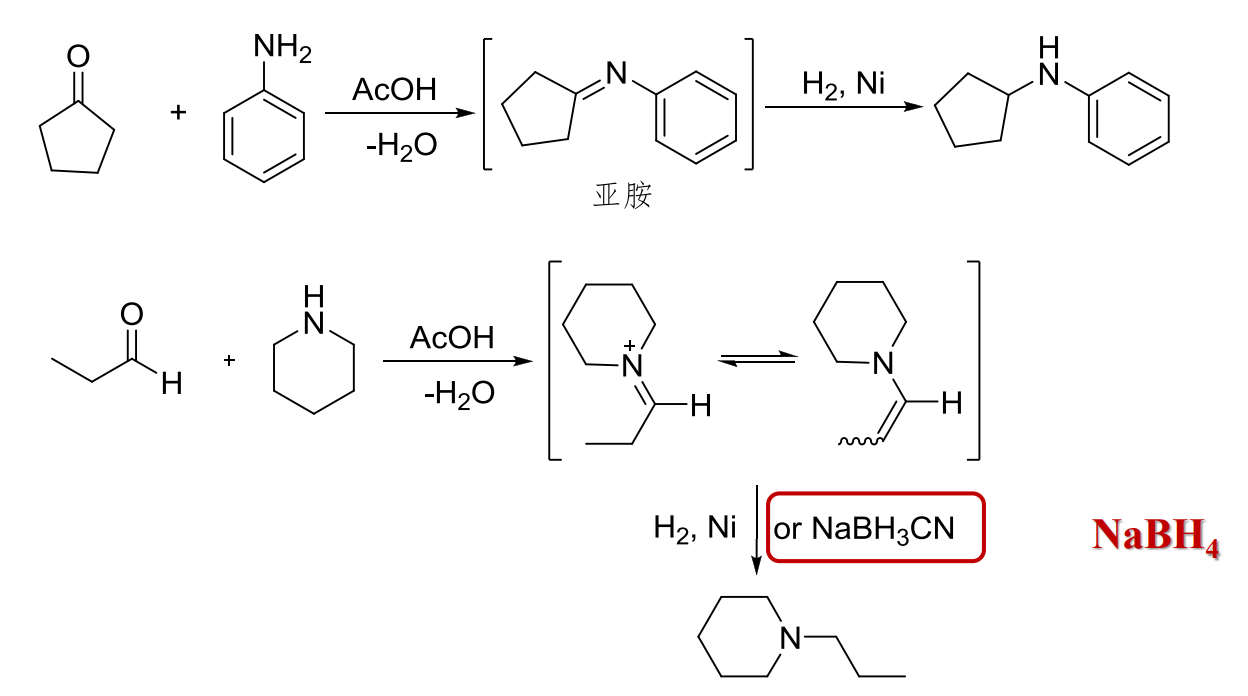
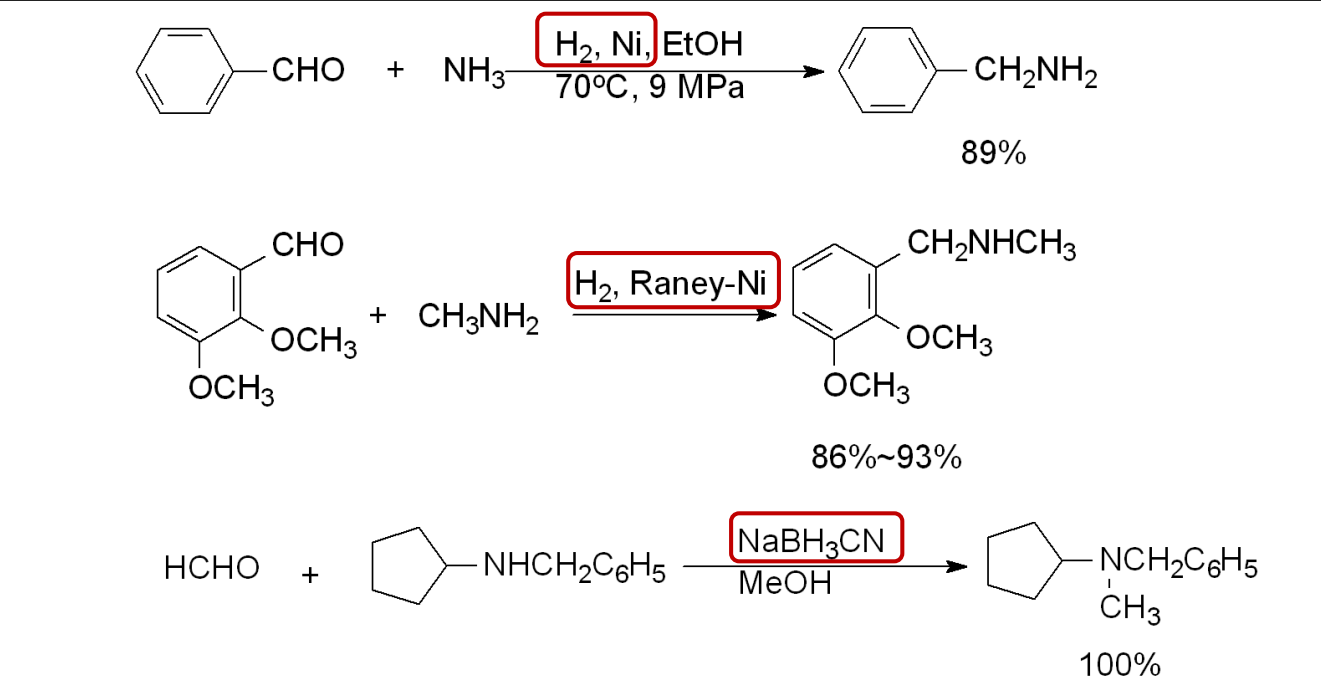
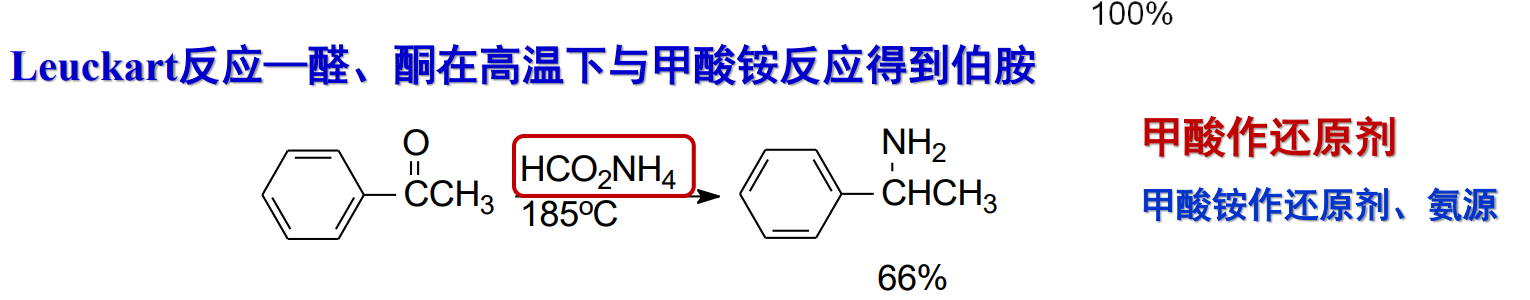
特别地,我们有Leuckart反应——醛、酮在高温下与甲酸铵反应得到伯胺:
13.4.3.6 总结
由此,对含氮化合物还原的总结如下:
13.4.4 Hofmann重排反应和Curtius重排
13.4.4.1 Hofmann重排
伯酰胺与氯气或溴在氢氧化钠溶液中反应,生成少一个碳原子(羰基碳)的伯胺,称为Hofmann重排,其反应如下:
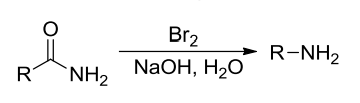
反应机理如下:
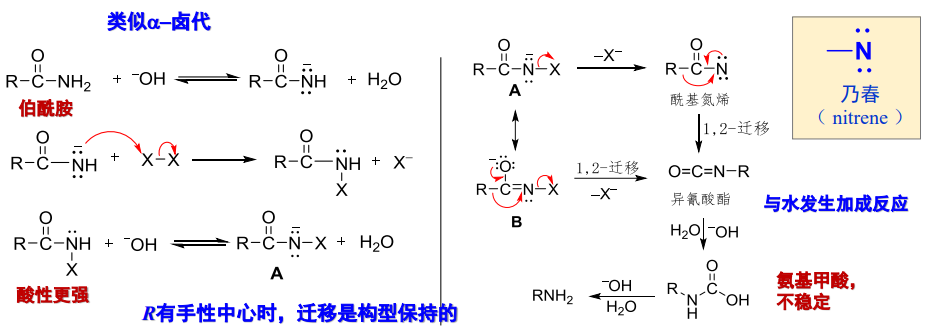
其反应大致分为两步,第一步是伯酰胺与氯气或溴在碱性条件下生成异氰酸酯,第二步是异氰酸酯在水溶液中发生水解与脱酸反应,净结果是获得一个缺少一个羰基碳的伯胺。
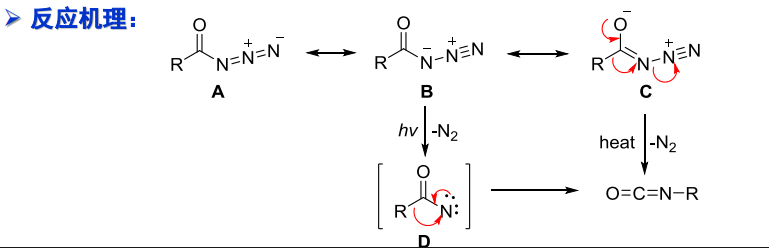
其中第一步涉及到氮烯中间体,其是发生重排反应的关键,原先与羰基碳相连的烃基会迁移至氮原子上。
这里再贴一个展示更加清晰的反应机理说明:
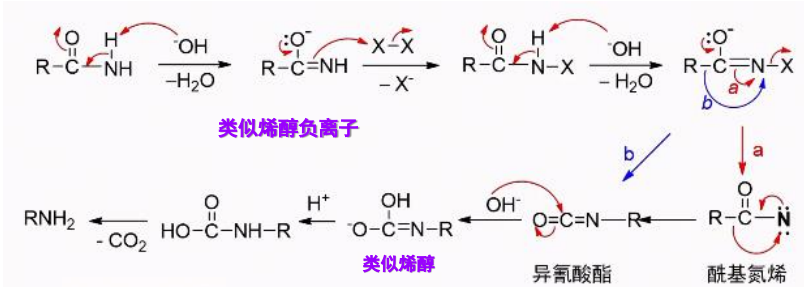
特别地,\(\ce{NaOCl/H2O}\)组合的效果也是类似的:
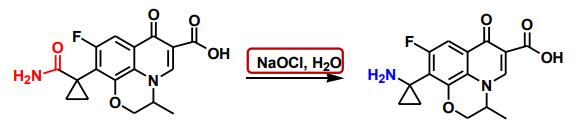
同时,在Hofmann重排反应中,如果发生迁移的烃基碳原子为手性碳,迁移时其构型保持。
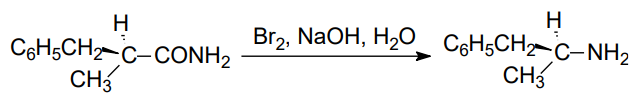
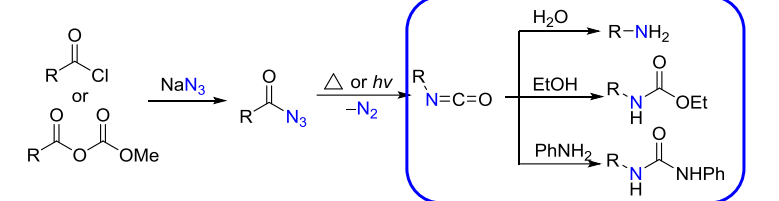
13.4.4.2 Curtius重排
酰基叠氮在惰性溶剂(如苯、环己烷等)中加热分解,失去氮气,也生成氮烯中间体,与Hofmann重排类似,后者发生重排,接着水解得到伯胺,这个反应被称为Curtius反应。
反应举例如下:
反应机理如下:
13.4.5 Mannich反应
含有活泼氢的化合物(通常为羰基化合物)与甲醛和二级胺或氨缩合,生成β-氨基(羰基)化合物的反应。
这也是这本书里唯一一个需要掌握的三组分有机反应。
反应举例如下:
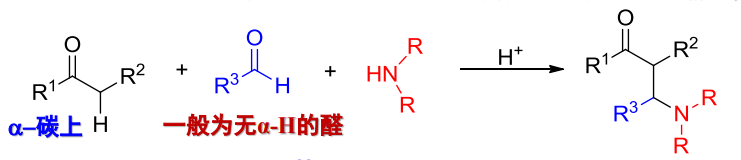
反应条件为\(\ce{HCl/EtOH}\),后在碱性条件下生成产物。
Mannich反应的机理如下:
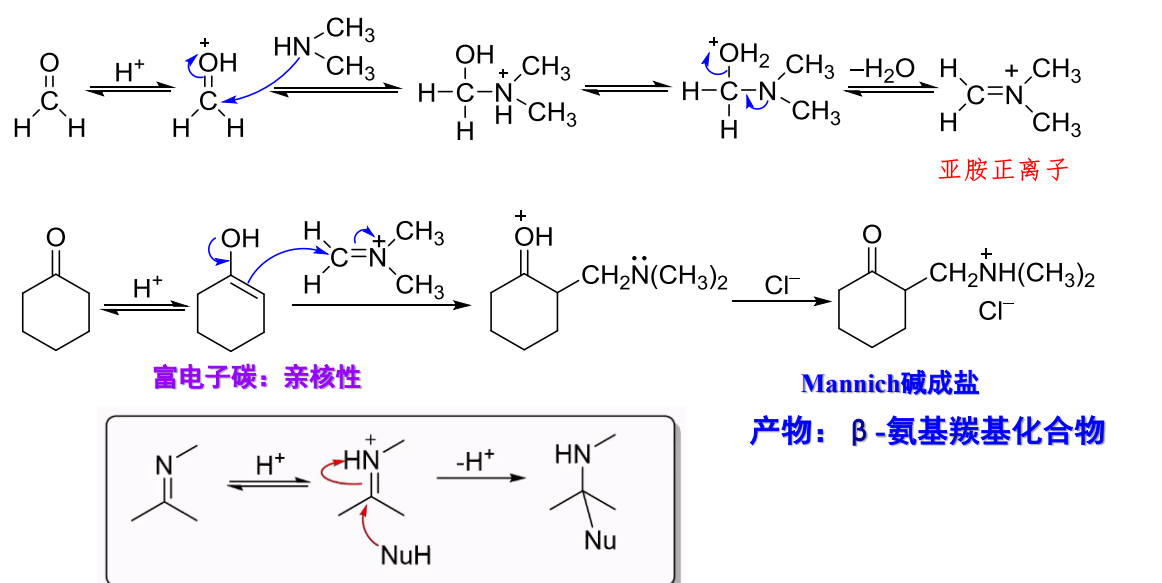
第一步是一般无\(\ce{\alpha-H}\)的醛与胺或氨气形成亚胺正离子,之后烯醇亲核进攻,获得胺甲基化产物。
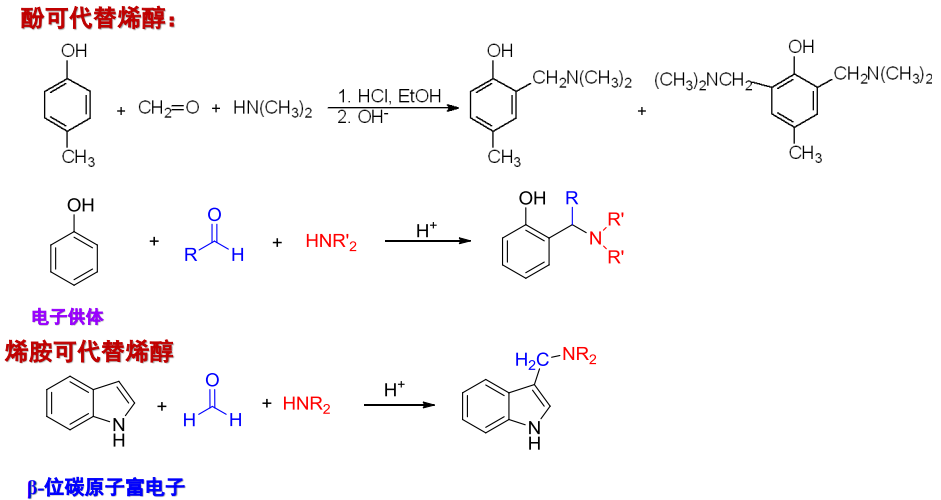
由如上反应机理,酚与烯胺均可以替代烯醇的位置,反正只要可以作为亲核试剂进攻亚胺正离子不就好了吗(
举例如下:
13.5 胺的反应
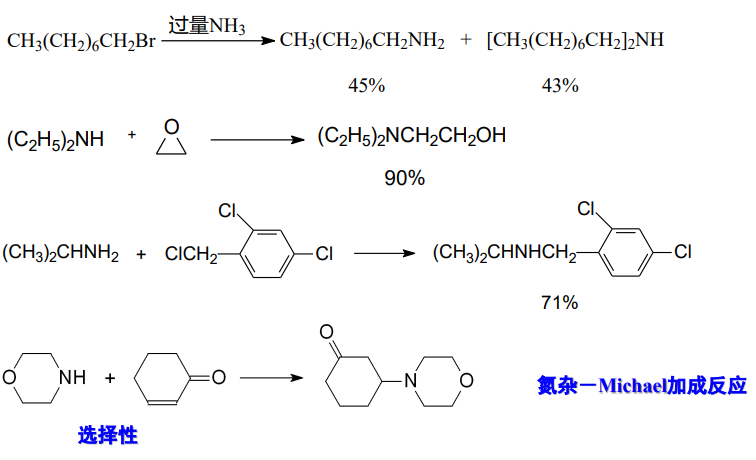
13.5.1 胺的烷基化
胺的烷基化同前文讨论过的氨的烃基化,本质上是\(\rm{S_N2}\)机理亲和取代反应。
反应举例如下:
13.5.2 胺的酰化
氮上有氢的胺可以被酰氯、酸酐等酰化试剂发生酰基化反应生成N-取代酰胺。
因此这个反应通常发生在伯胺与仲胺上。
反应举例如下:
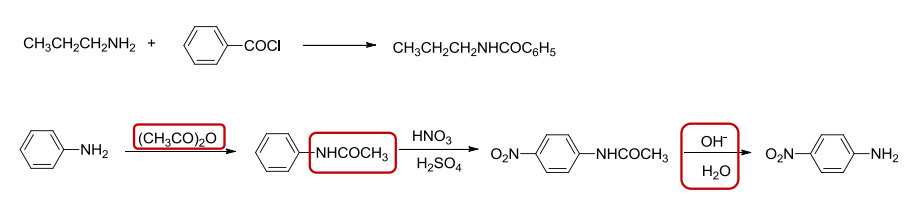
如上图反应二,同苯的磺化、羰基的缩合反应,胺的酰化也是可逆的,在碱性条件下即可还原回氨基。在有机合成中常用胺的酰化保护氨基。同时对于上述反应来说,苯胺酰化后,苯环反应活性较低,可以更好的获得一硝化产物。
磺酰氯与伯胺和仲胺的反应与酰氯相似,分别生成N-烃基磺酰胺和N, N-二烃基磺酰胺,其中N-烃基对甲苯磺酰胺能溶于氢氧化钠水溶液中:
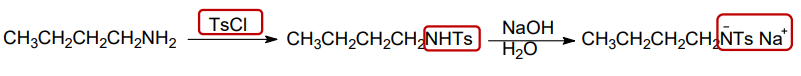
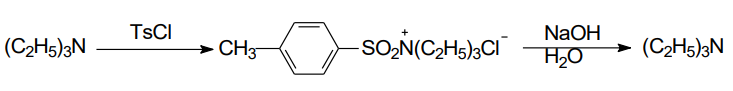
而磺酰氯与叔胺反应只生成盐,在氢氧化钠作用下发生逆反应,得到原叔胺:
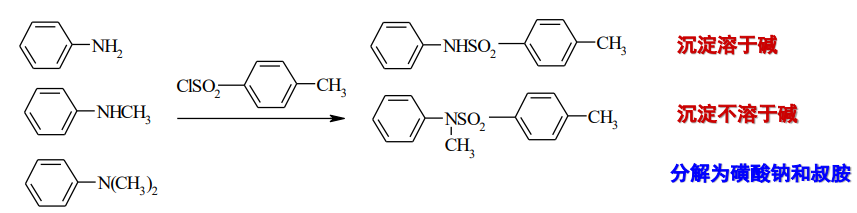
于是,我们可以利用伯、仲、叔胺与磺酰氯反应不同来鉴别伯、仲、叔胺,这个反应称为兴斯堡(Hinsberg)反应:
13.5.3 胺的氧化和Cope消除反应
过氧化氢或过氧酸氧化三级胺可以得到氧化叔胺:
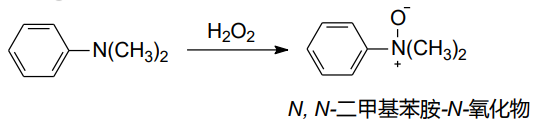
而含有\(\ce{\beta-H}\)的氧化叔胺,可以热分解反应——Cope反应,生成烯烃和羟胺:
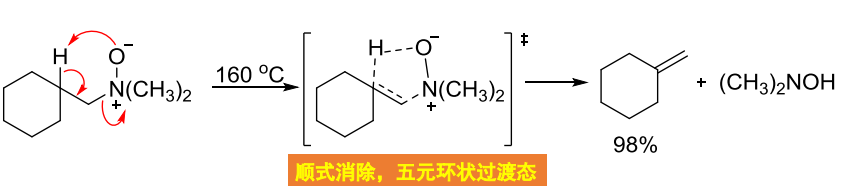
在立体选择性上,这个反应遵循顺式消除:
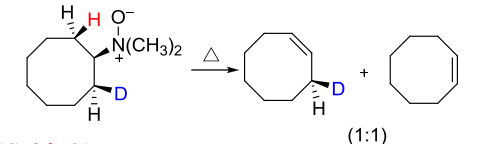
区域选择性上,有两种不同的\(\beta-H\)时,生成两种烯烃的混合物,同时以Hofmann消除——取代少的烯烃为主。
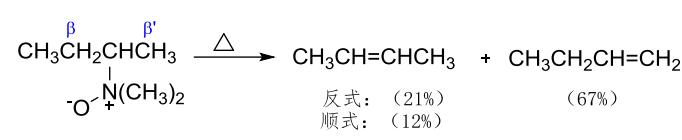
总的来说,Cope消除主要是Hofmann消除,生成的烯烃取代少;而卤代烃在强碱下主要为扎伊采夫消除,生成的烯烃取代多。
13.5.4 胺与亚硝酸反应
仲胺与亚硝酸反应,生成N-亚硝基胺:
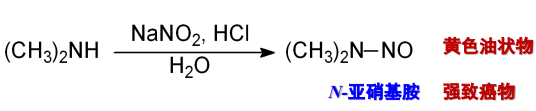
伯胺用亚硝酸处理也生成N-亚硝基胺,但它不稳定,能进一步转化为重氮盐:
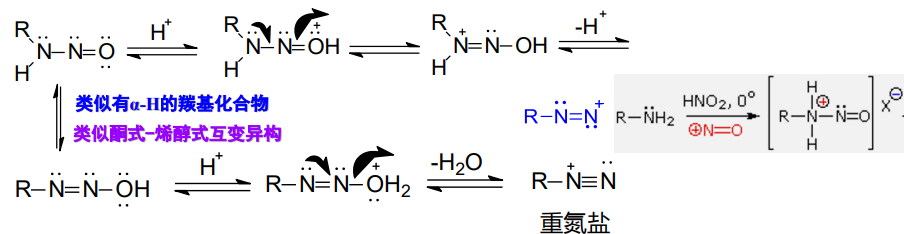
由于氮气的离去能力很强,脂肪族伯胺生成的烷基重氮盐在低温下也会放出氮气生成碳正离子,并按碳正离子的机理继续反应。
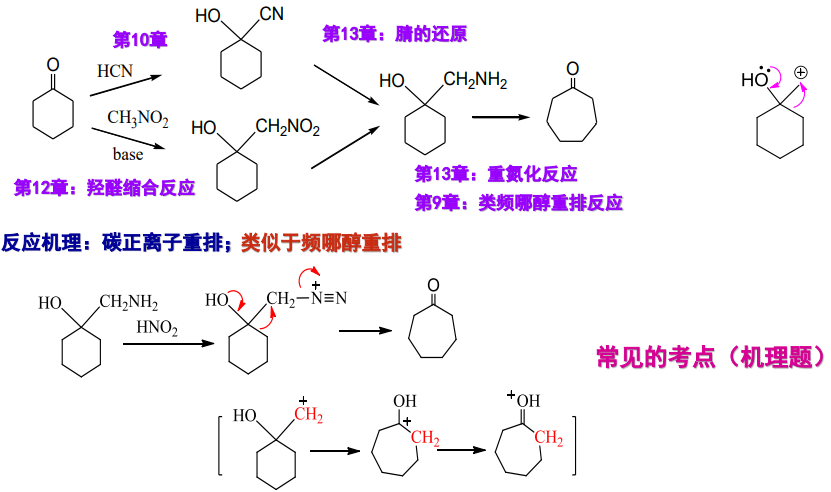
基于以上机理,邻氨基醇与亚硝酸反应生成的重氮盐可以发生类频哪醇重排——Tiffeneau-Demjanov重排,缩写TDR:
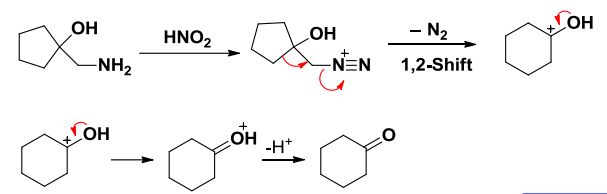
其迁移机理已经在第九章中,有关于频哪醇重排反应的部分说明,再次不过多赘述。
脂肪胺重氮化反应可以用于脂肪烃的扩环反应上:
而芳香族伯胺与亚硝酸反应生成的芳香重氮盐要稳定得多,反应举例如下:
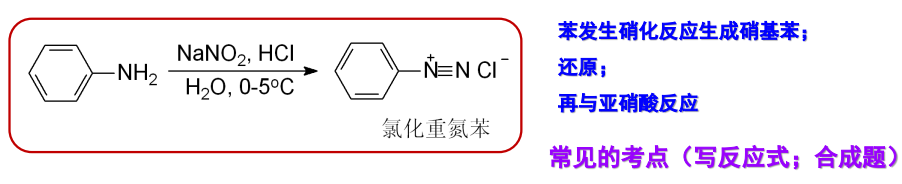
叔胺氮上没有氢,所以不能与亚硝酰正离子反应。但芳香族叔胺与亚硝酸主要发生芳环上的亲电取代反应,此时叔胺基作为苯环上的一个活化基团存在:
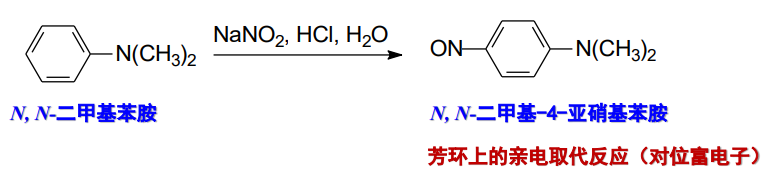
芳香胺与亚硝酸反应的总结如下:
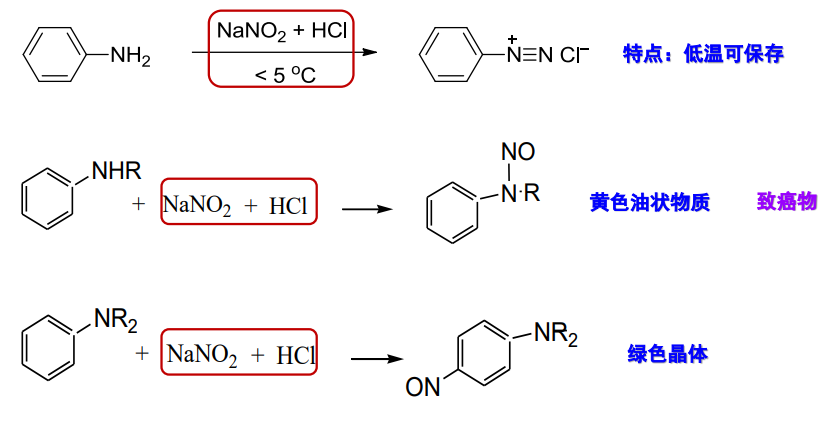
鉴于脂肪胺到芳香胺,以及伯胺到叔胺与亚硝酸反应的不同特点,其亦可用于鉴别结构不同的胺。
13.5.5 芳香胺的亲电取代反应
对于一般的芳环上溴代、硝化、磺化反应,为了控制其取代数,会先保护氨基,并降低苯环的反应活性:
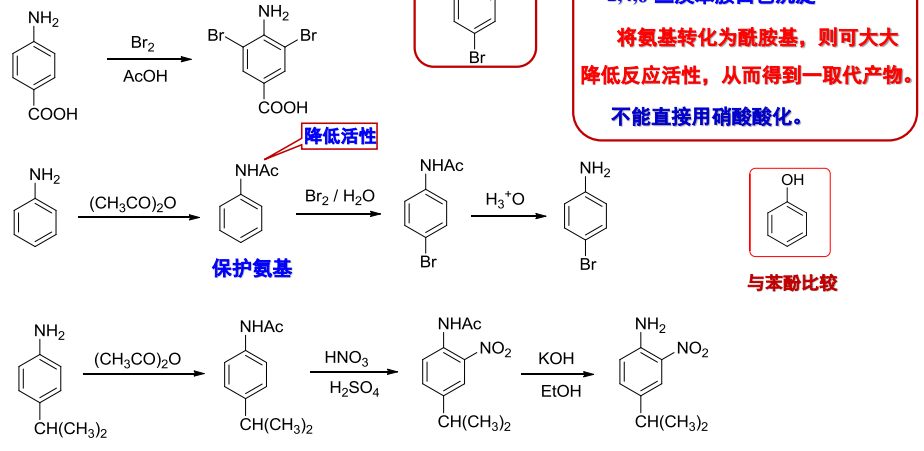
而在发生FC酰基化时,芳香族伯胺或仲胺会与酰氯反应,生成酰胺,在此之前应该先保护氨基:
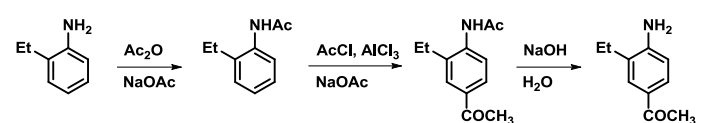
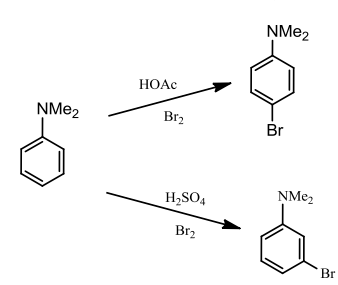
同时我们应该考虑到氨基既有碱性,也有酸性,苯胺在醋酸(弱酸)中为游离胺,在硫酸(强酸)中则形成铵盐,铵基正离子为间位定位基,两种体系pH不同,产物也不同:
13.6 季铵盐和季铵碱
13.6.1 季铵盐与相转移催化剂
季铵盐为离子型化合物,其易溶于水,具有较高的熔点,常在熔点分解,这些都是盐类的特征;而季铵盐氮上的正电荷被三个烃基屏蔽,使得其也具有一定的脂溶性,易溶于很多有机溶剂。
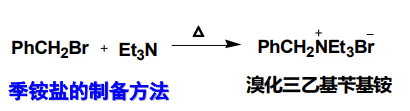
季铵盐可由叔胺与卤代烷共热制备:
季铵盐所具有的水溶性与脂溶性共存的特点使得其可以轻易在有机相与水相之间转移,所以其常常被用于一些特殊的反应场景当中:
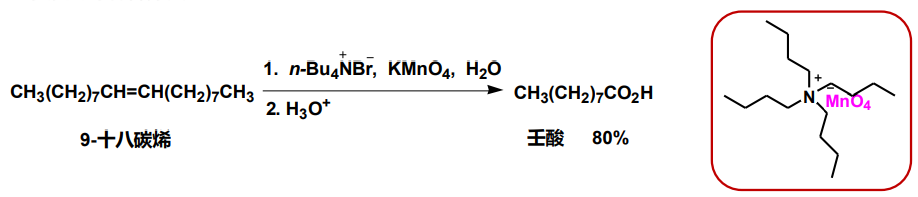
季铵盐的作用是将高锰酸负离子从水相转移到有机相,从而使氧化反应能够顺利进行,而它的用量只需催化量(一般为反应物的5 mol%以下),被称为相转移催化剂(phase transfer catalysts)。
下图展示了季铵盐如何带着高锰酸负离子反复横跳:
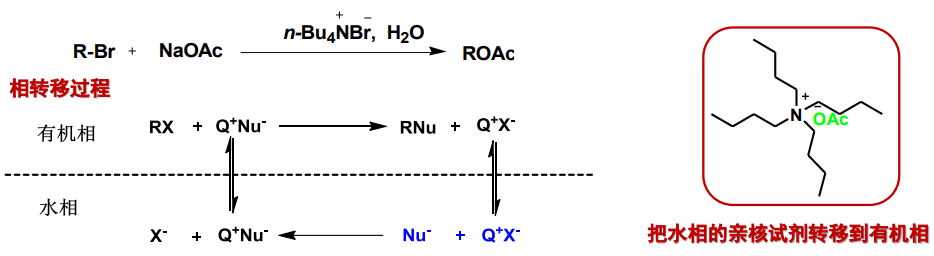
13.6.2 季铵碱的生成与热消除反应——Hofmann消除
以季铵盐为反应物,季铵碱常用的制备方法如下:
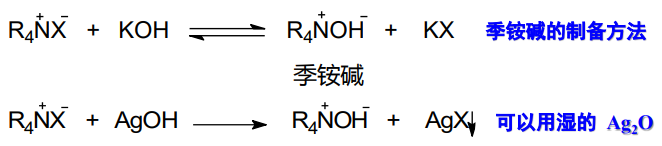
对于第二个反应,我们常用湿的氧化银反应,第一是因为氢氧化银不稳定,第二个是此反应生成卤化银沉淀,因而可以进行。
对于Hofmann消除,其指的是含有\(\ce{\beta-H}\)的季铵碱,在受热时则分解为烯烃、叔胺和水。且其遵循Hofmann规则。
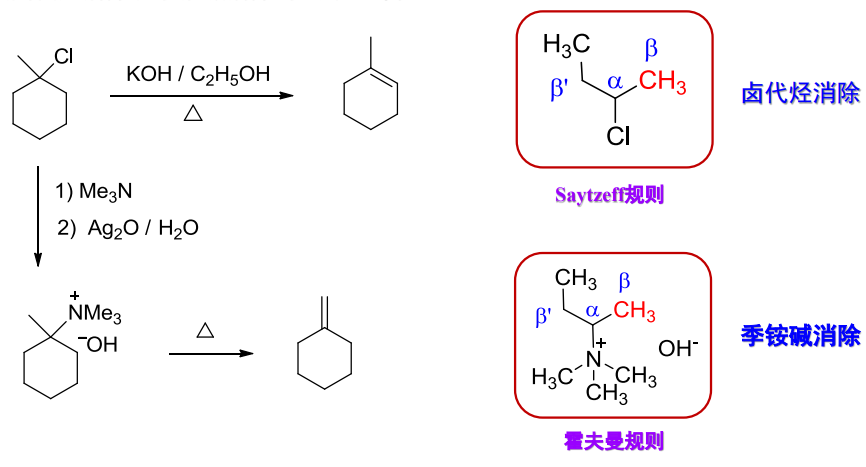
Hofmann规则
当与氮原子相连的烷基上有两种不同的\(\ce{\alpha-H}\)时,反应通常以生成含烷基较少的烯烃为主。这与卤代烷消除取向的Saytzeff规则相反。
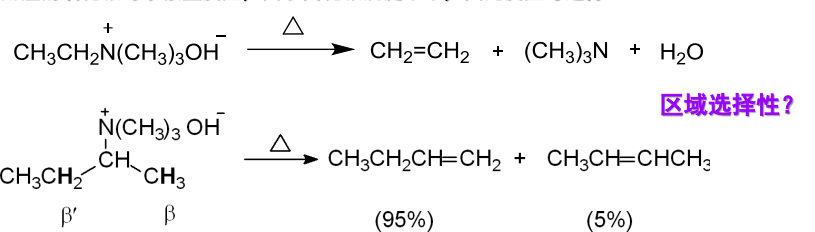
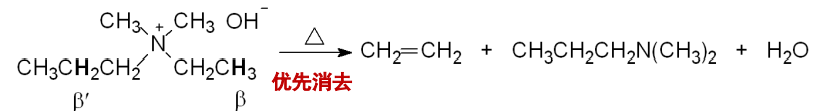
Hofmann规则的合理解释是,Hofmann消除反应按照E2消除反应机理进行,\(\ce{\beta-H}\)的酸性与空间位阻将决定反应的区域选择性,机理展示如下:
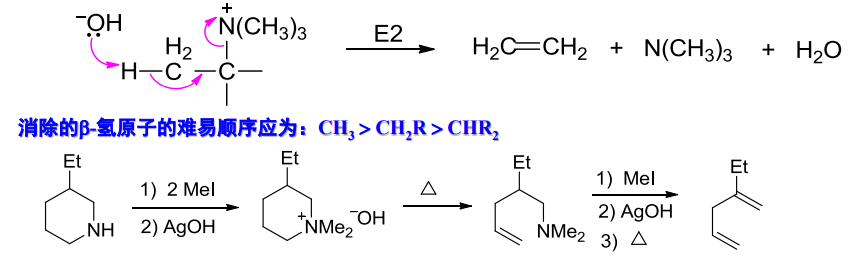
Hofmann消除反应的应用之一,是切断\(\ce{C-N}\),实现对胺结构的测定或合成烯烃.
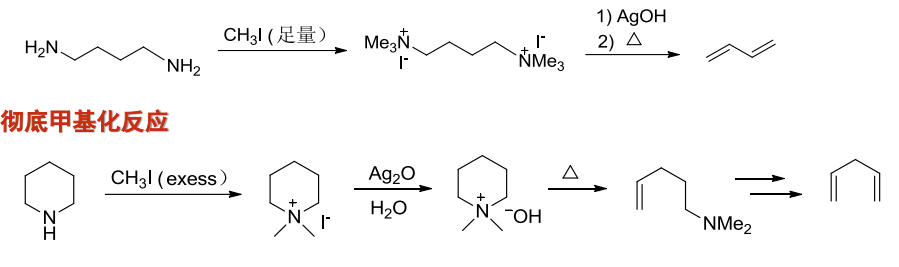
常见的考题如下(关注第二个反应,其利用了两次Hofmann消除):
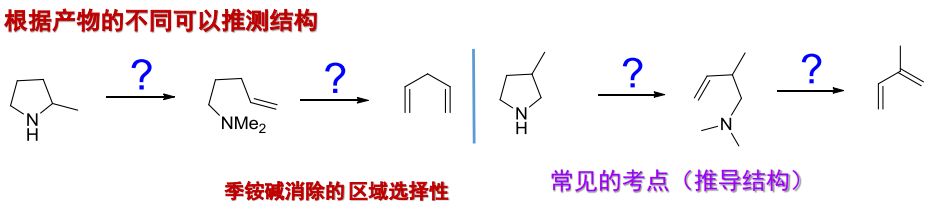
下图比较了卤代烃消除和季铵碱消除的区域选择性:
13.7 重氮化合物的合成与应用
重氮化合物的分子通式为\(\ce{R2CN2}\),常见的重氮化合物如下:
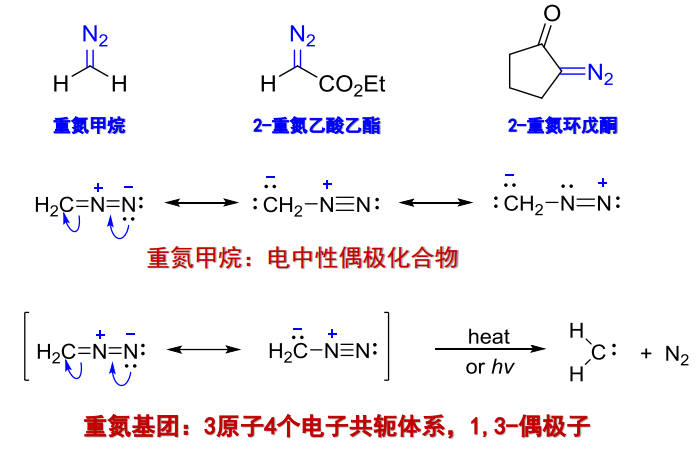
13.7.1 *重氮化合物的制备
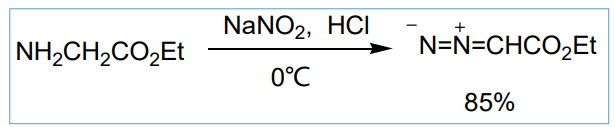
重氮化合物的制备一般有两种方法,一个是通过伯胺的亚硝化反应制备:
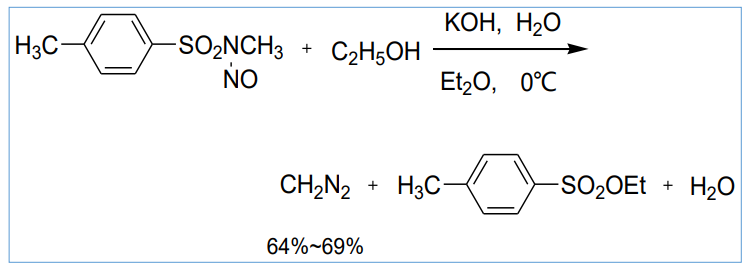
另一个是重氮甲烷的制备:
13.7.2 重氮甲烷的性质和反应
重氮甲烷的性质:
- 易爆炸
- 甲基化试剂
- 能与羧酸、烯醇反应,制备相应的酯、醚
反应举例如下:
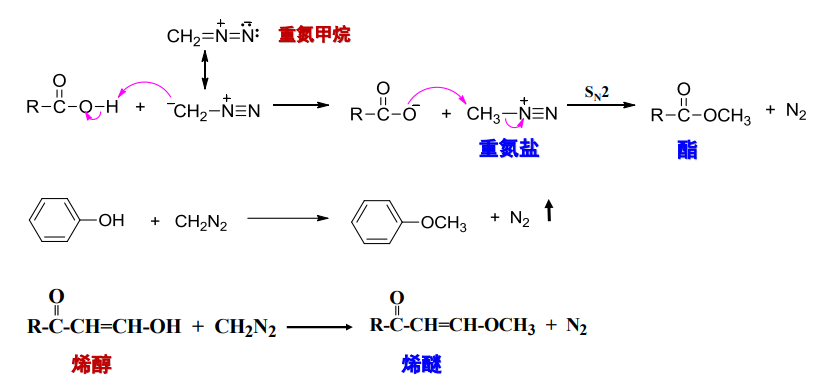
正如前文中,伯胺与亚硝酸反应所提到的一样,氮气是一个很好的离去基团,羧酸与烯醇均可以作为亲核试剂,与重氮甲烷发生亲核取代反应。
而重氮化合物的另一个重要性质是在光照或加热时生成卡宾(carbene),又称碳烯,卡宾是重要的有机合成活性中间体,可用通式\(\ce{R2C:}\)表示,其可与烯烃发生加成成环反应:
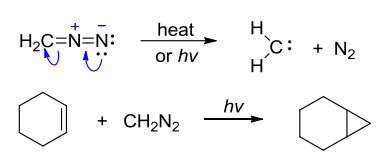
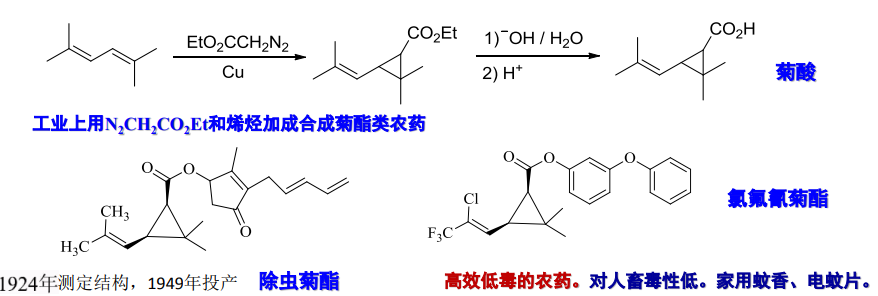
工业上常用其合成菊酯类农药:
13.8 芳基重氮盐的反应及其应用
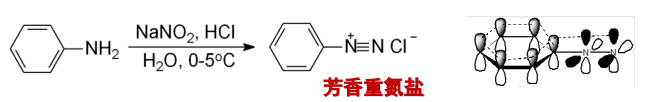
补充前文:芳香伯胺在低温及强酸(盐酸或硫酸)水溶液中与亚硝酸作用生成的重氮盐反应叫重氮化反应:
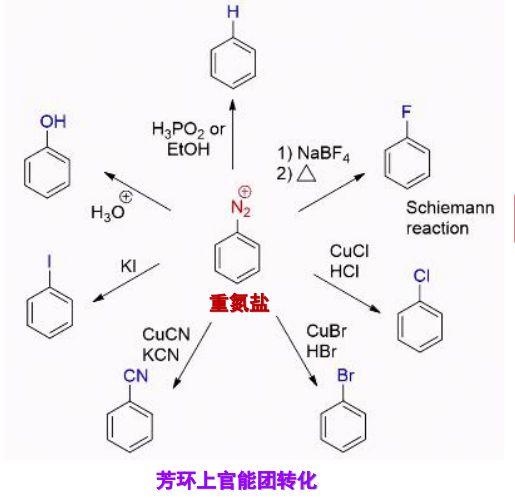
对芳香重氮盐反应的总结如下:
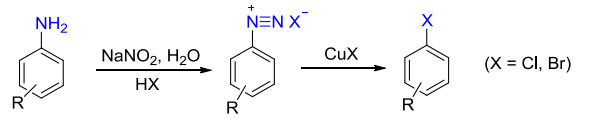
13.8.1 重氮盐被卤素和氰基取代
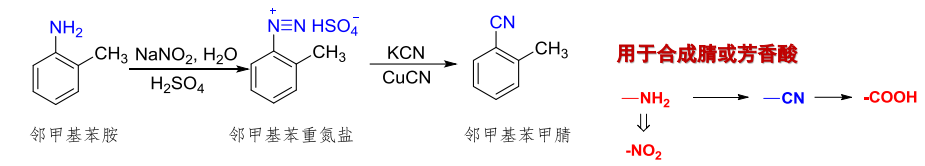
一种是Sandmeyer反应,重氮盐基团被\(\ce{Cl、Br、CN}\)取代,催化剂为对应的\(\ce{Cu(I)}\)盐:
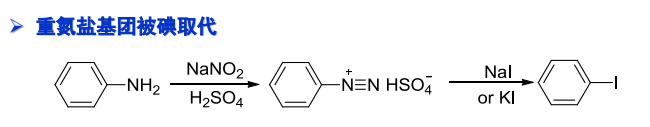
一种是被碘取代,反应如下:
一种是被氟取代,反应举例如下:
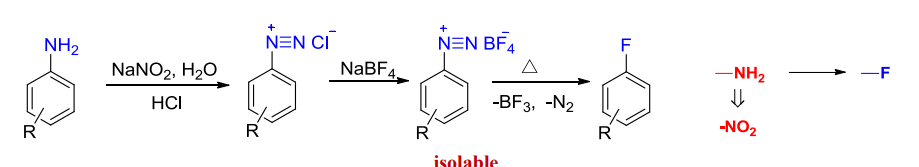
此反应称为为席曼(Schiemann)反应,它是由芳胺制备氟代芳烃的常用方法。
13.8.2 重氮基被硝基和亚磺酸基取代
在金属铜催化下,重氮基与亚硝酸盐或亚磺酸盐反应,可生成硝基或磺酸基,此反应称为加特曼(Gatterman)反应。
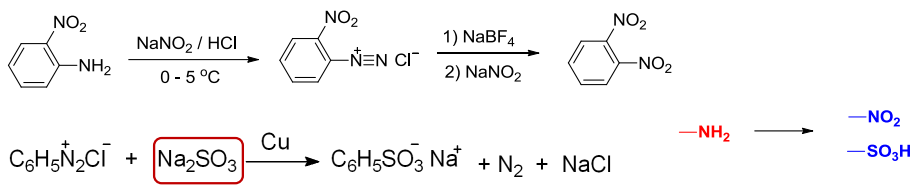
应用举例如下:
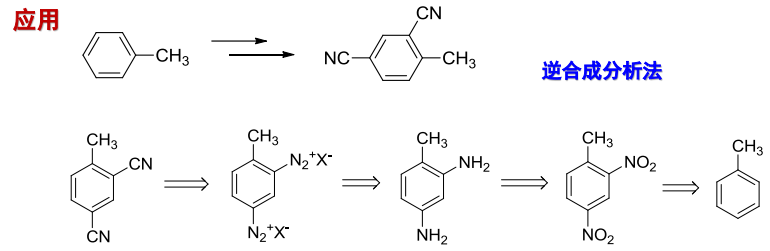
13.8.3 重氮盐的还原
芳基重氮盐在一些还原剂存在下,能够发生重氮基被氢原子取代的反应。这是一种还原脱胺反应,常用的还原剂为次磷酸、乙醇和硼氢化钠。
反应举例如下:
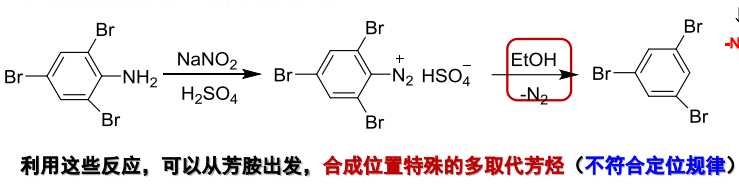
对于其的合成应用,可见下图:
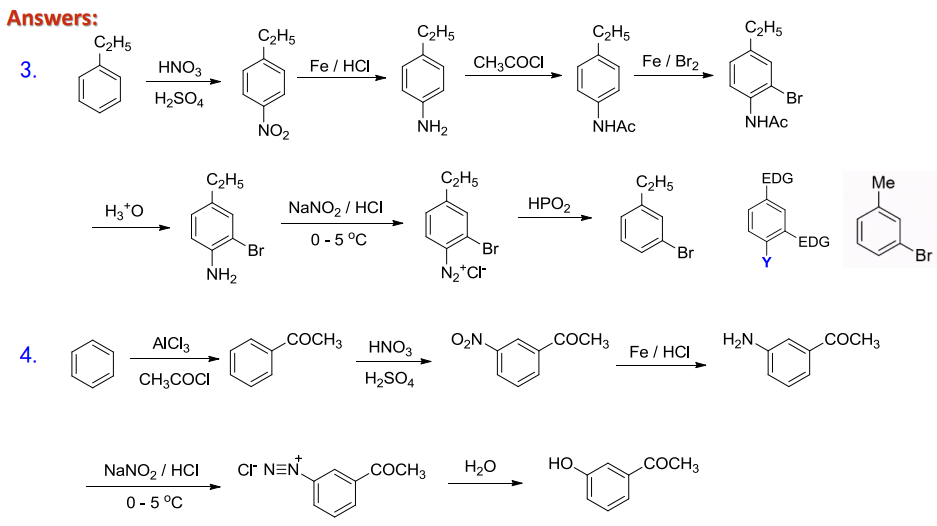
13.8.4 重氮盐的水解
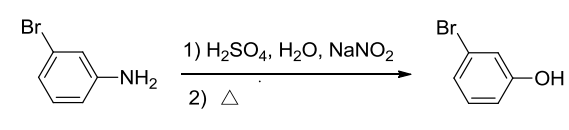
而冷的芳基重氮盐在水溶液中也会慢慢分解,与水分子作用生成酚。
13.8.5 重氮盐的亲电取代反应
重氮盐作为亲电试剂,可在碱性条件下与带有强给电子基团的芳香族化合物(酚和芳胺——富电子芳香化合物)发生C—N键的偶联反应,生成偶氮化合物。
其反应举例如下:
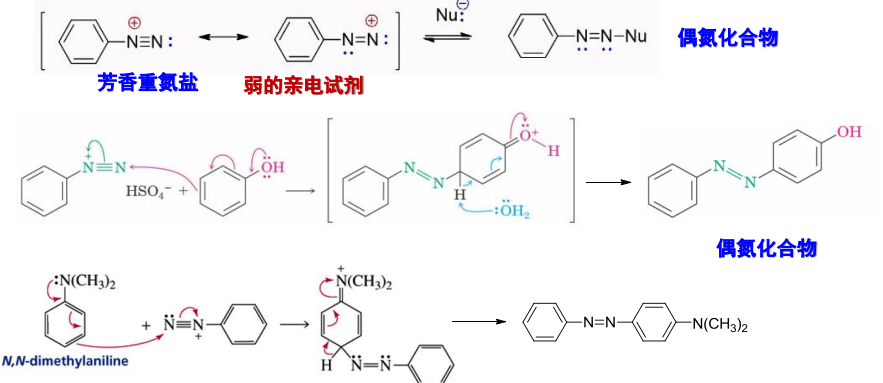
在区域选择性上,与苯环亲电取代反应的区域选择性类似,对于带有强给电子集团,也就是活化基团的芳香环,偶联反应的位点一般发生在对位上,如对位被占据,则进入邻位:
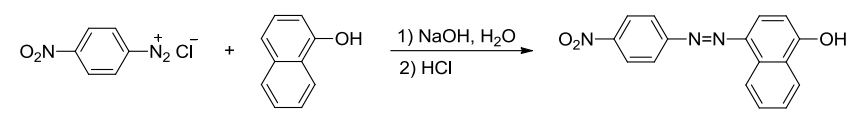
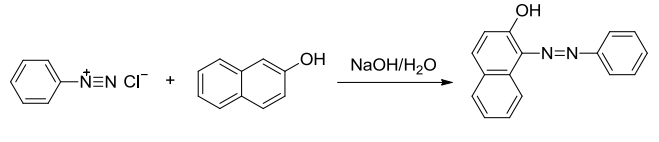
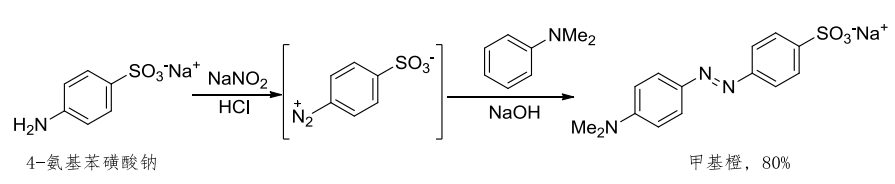
其中图二产物为苏丹红I号,图三产物为甲基橙,都是常用的染料。