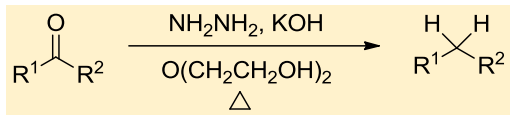第十章 醛和酮亲核加成反应
10.1 醛酮的结构和命名
醛和酮都是一种羰基化合物\(\ce{(C=O)}\)。
常见的羰基化合物如下:
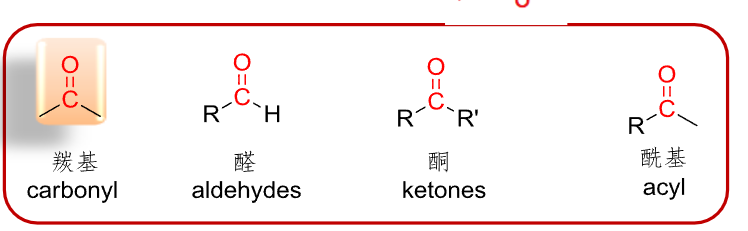
一般羰基化合物可以分类为:
- 脂肪醛
- 芳香醛
- 脂肪酮
- 芳香酮
10.1.1 醛和酮的结构
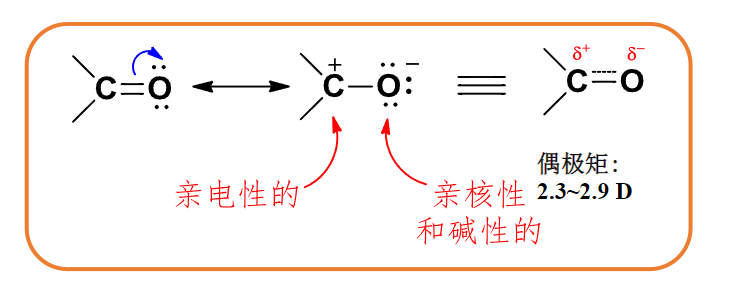
对于一个碳基,其上碳氧通常采取\(\ce{sp^2}\)杂化,共振式如下:
10.1.2 醛和酮的命名
醛命名的特殊性
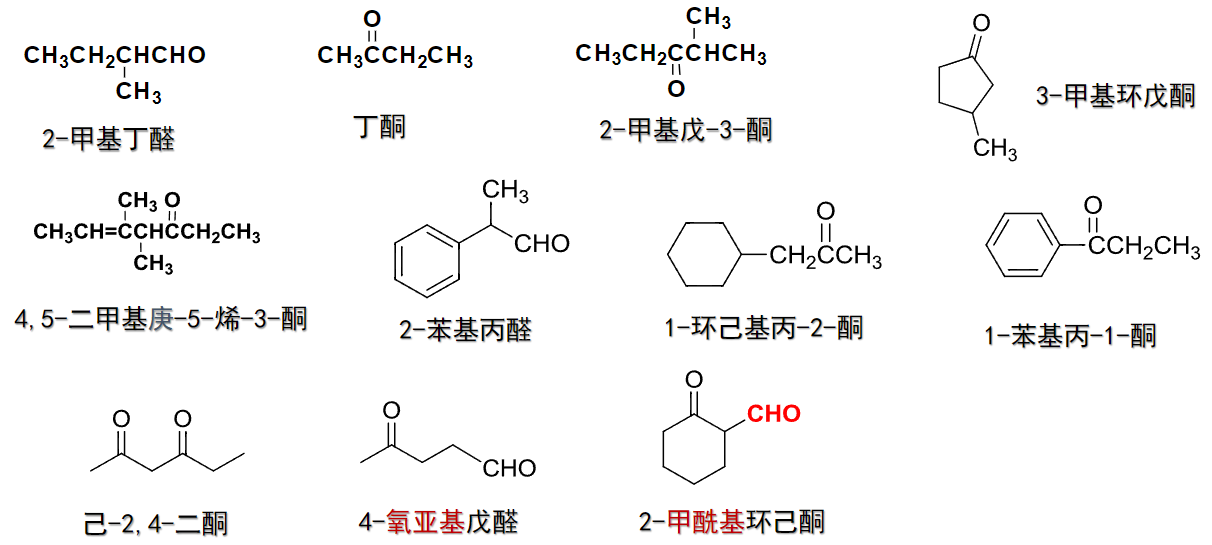
由于醛羰基一定在碳链的一端,故在命名的时候不必标出其羰基位次。
常见的醛、酮命名如下:
10.2 醛和酮的物理性质
羰基是极性基团,因此醛酮分子一般都是极性分子,羰基中的氧原子可以与水形成氢键,低分子量的醛酮可溶于水,也可溶于有机溶剂。
醛或酮分子间不能形成氢键,不存在缔合现象。
10.3 醛和酮的制备
10.3.1 由醇制备
醇制备醛酮本质上是一个氧化过程,常用的氧化剂有:Jones试剂(\(\ce{CrO3}\)/稀硫酸)、铬酸(仲醇氧化)、Collins试剂、氯铬酸吡啶盐(PCC)、重铬酸吡啶盐(PDC)等等。
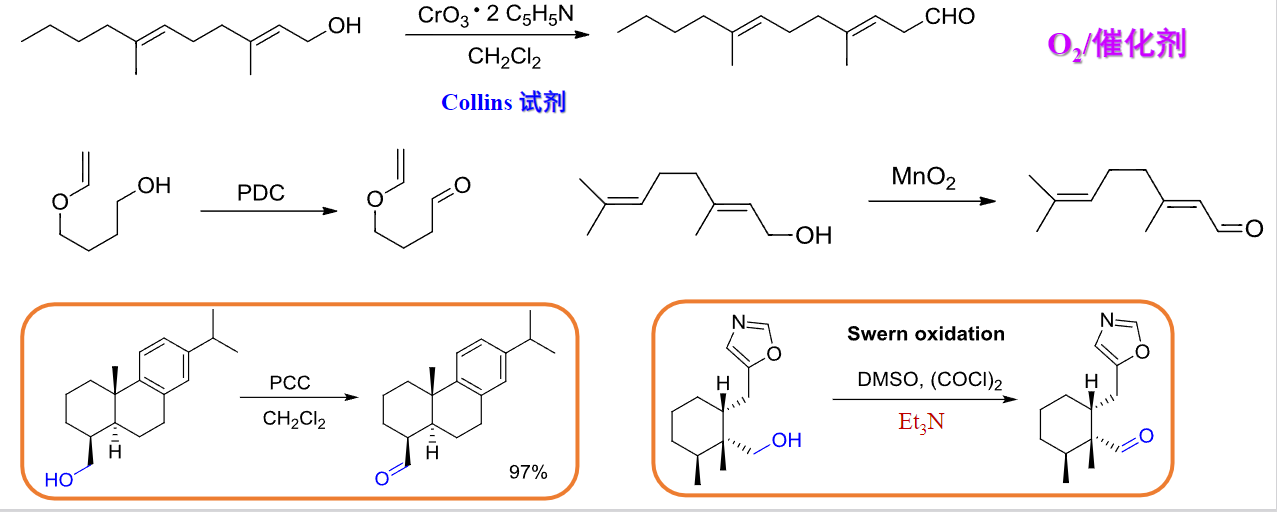
Collins试剂
Collins试剂由\(\ce{CrO3\cdot 2C5H5N}\)与\(\ce{CH2Cl2}\)混合而成。Swern氧化
醇在二甲基亚砜(DMSO),\(\ce{(COCl)2}\)和\(\ce{Et3N}\)条件下可以发生Swern氧化,这在第九章中已有提及。
10.3.2 由烯烃和炔烃制备
涉及碳碳重键的加成:
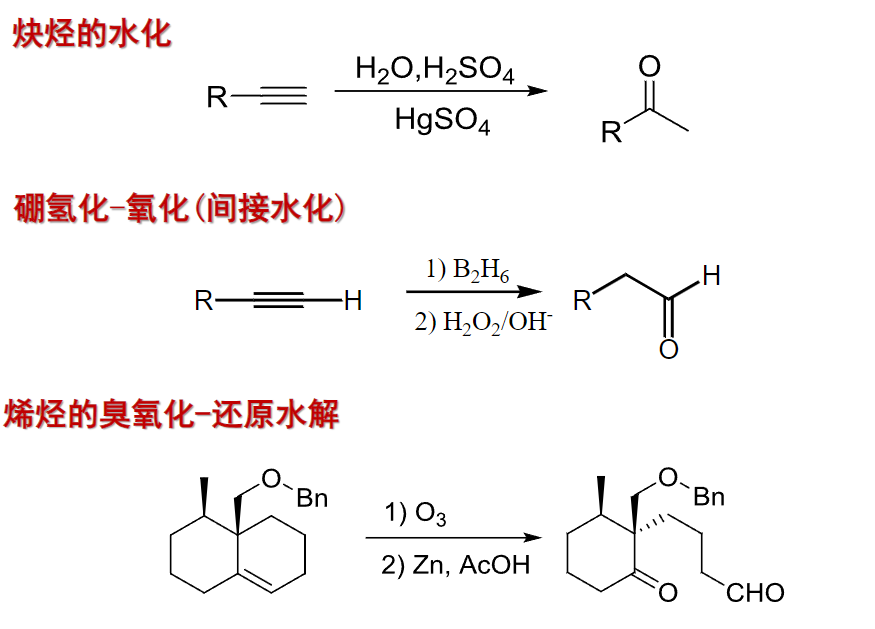
这些均在第四章中有所提及。
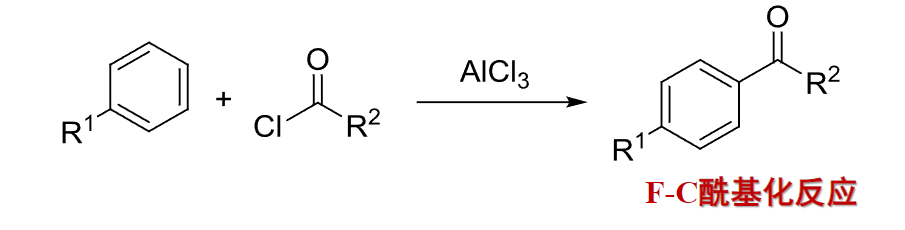
10.3.3 由芳烃制备
通过博克酰基化制备芳基烷基酮:
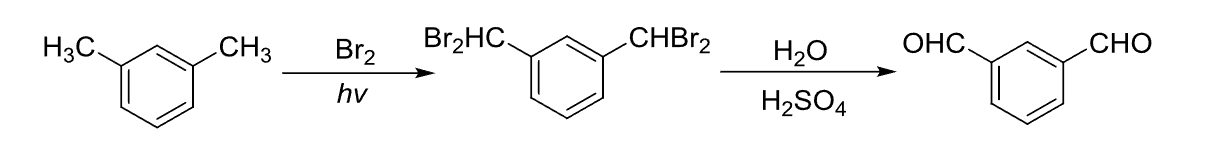
还有偕二卤代物水解:
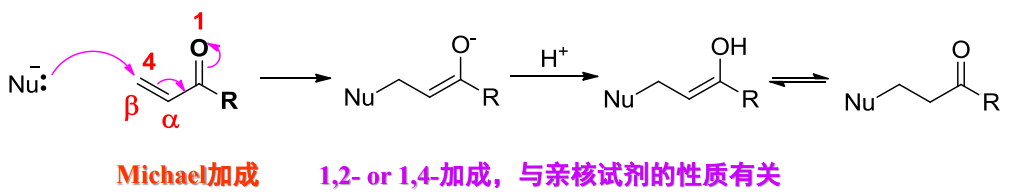
10.4 醛和酮的亲和加成反应
常见的反应位点如下:
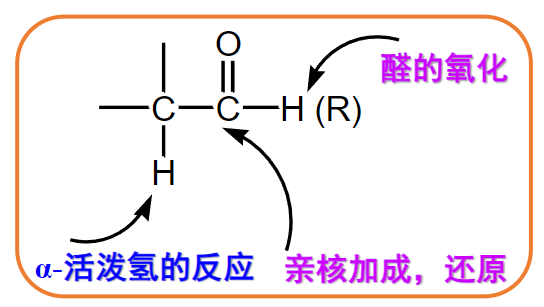
由于羰基氧电负性较大,使得碳上带有部分正电(由前文共振式可知),容易发生亲核加成。
醛酮发生亲核加成反应的机理如下:
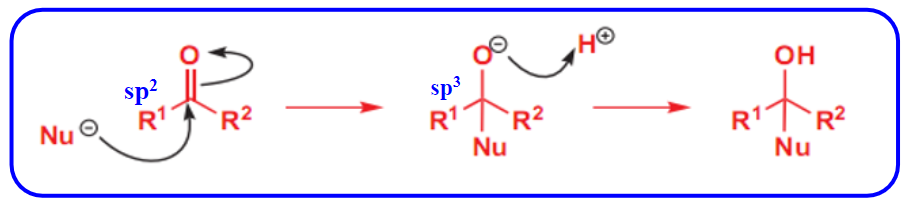
特征为:
- 反应分步进行,第一步亲核试剂加成是决速步。
- 亲核试剂越强,速率越快。大部分的反应是可逆的。
醛酮发生亲核加成反应的活泼性有如下影响因素:
- 空间位阻:羰基相连的基团越小越有利;基团越大,空间位阻越大
- 电子效应:羰基碳上的正电性越强,越有利。羰基碳上有吸电子基团对反应有利。烃基是推电子的基团,亲核加成反应变难。
常用的亲核试剂如下:
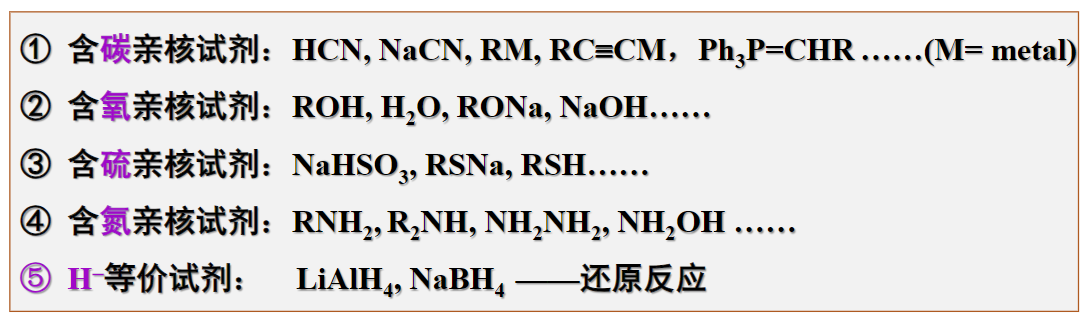

接下来我们将对其中部分的试剂反应进行介绍。
10.4.1 与含碳亲核试剂加成
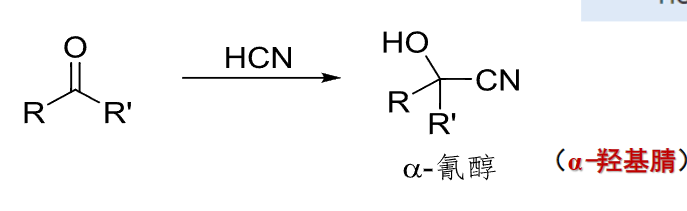
10.4.1.1 与氢氰酸加成
与氢氰酸加成
- 亲核试剂:\(\ce{HCN}\)
- 亲核性:弱
- 立体化学:无对映体选择性
反应如下:
用途:合成\(\alpha\)-羟基腈、\(\alpha\)-羟基酸、\(\alpha,\beta\)-不饱和酸
反应机理如下:
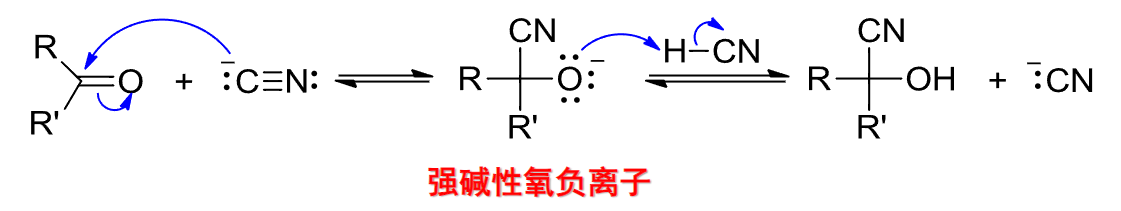
一般保持反应在偏碱性(微量碱)条件下进行,在实际操作中,先混合\(\ce{NaCN}\)和醛或酮,再加酸进行反应。
这个反应限制在醛、脂肪族甲基酮、少于8个碳原子的脂环酮。
常见的反应如下:
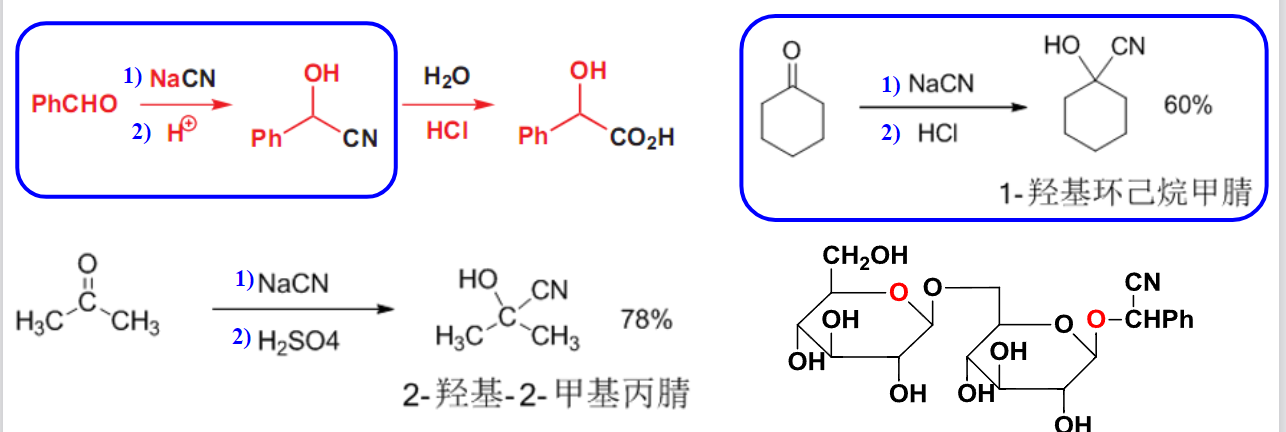
由于反应中同样引入了氰基,可以通过其进一步的水解生成酰胺基或者羧酸来达到增长碳链的目的。
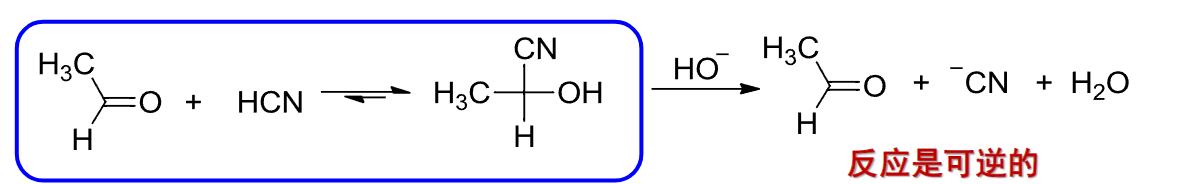
对于某些反应来说,氰基的加成是可逆的,加入一些碱即可:
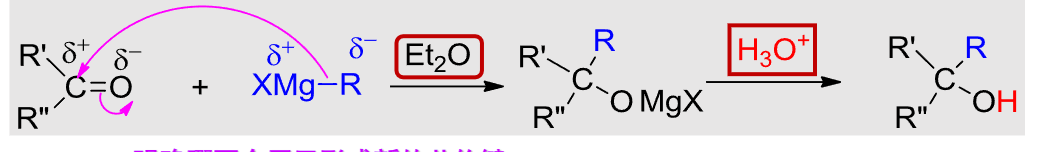
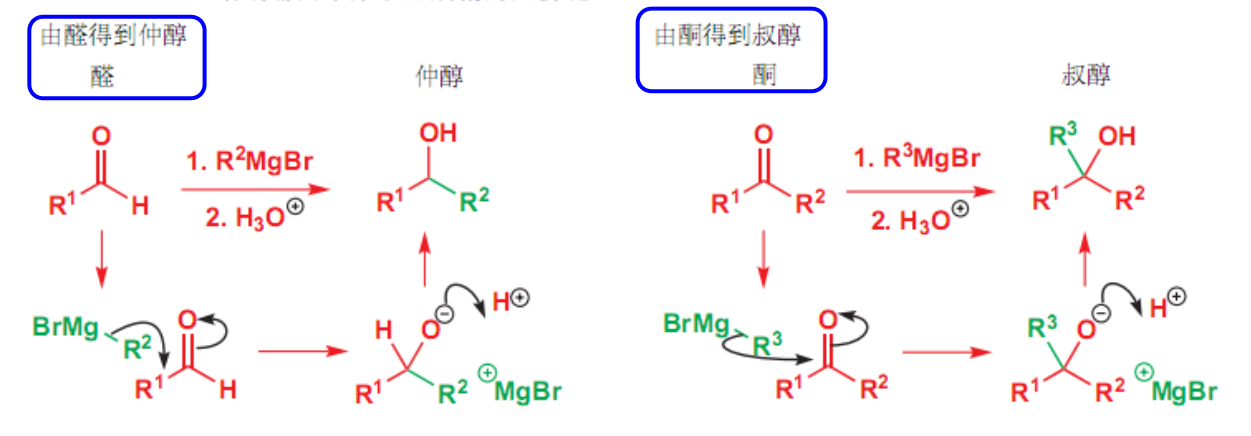
10.4.1.2 与格式试剂加成
与格式试剂加成
- 亲核试剂:\(\ce{XMg-R}\)
- 亲核性:强
- 立体化学:无对映体选择性
反应如下:
用途:由醛得到仲醇,由酮得到叔醇。
格式试剂的制备不再过多赘述,将卤代烃与\(\ce{Mg}\)在无水乙醚中混合制备。
格式试剂在无水乙醚或者四氢呋喃(THF)中与含氢原子的炔基混合可以实现\(\ce{-MgX}\)基团的转移。
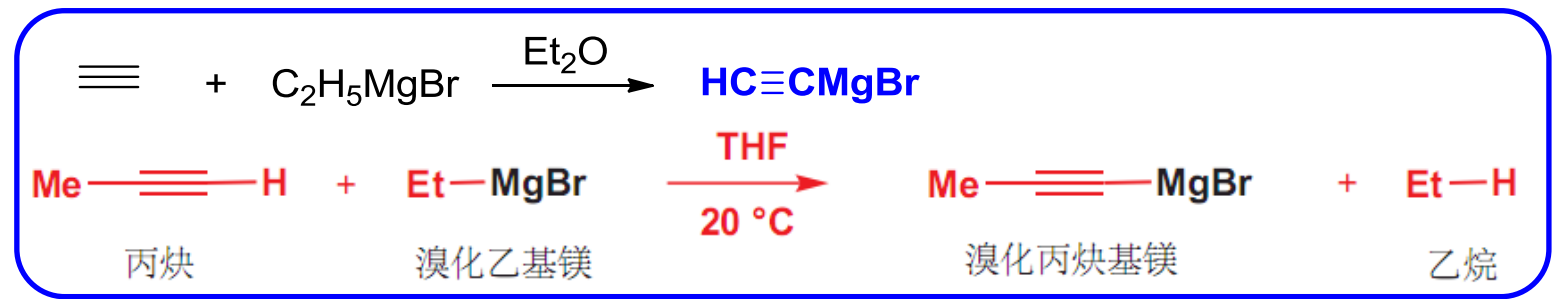
格式试剂与不同位置的羰基生成不同的醇:
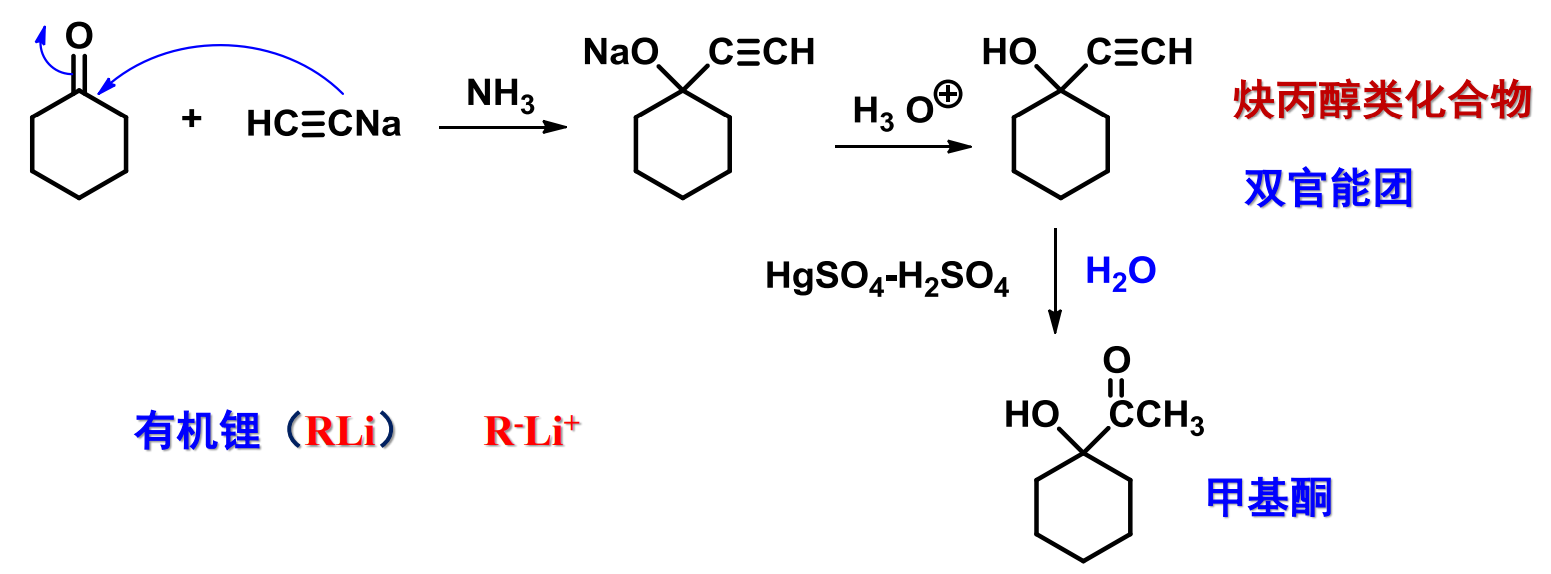
10.4.1.3 与金属炔化物加成
与金属炔化物加成
- 亲核试剂:\(\ce{RC#C-}\)
- 亲核性:强
- 立体化学:
反应如下:
用途:由酮制备带炔基的醇
金属炔化钠主要通过以下反应制备:
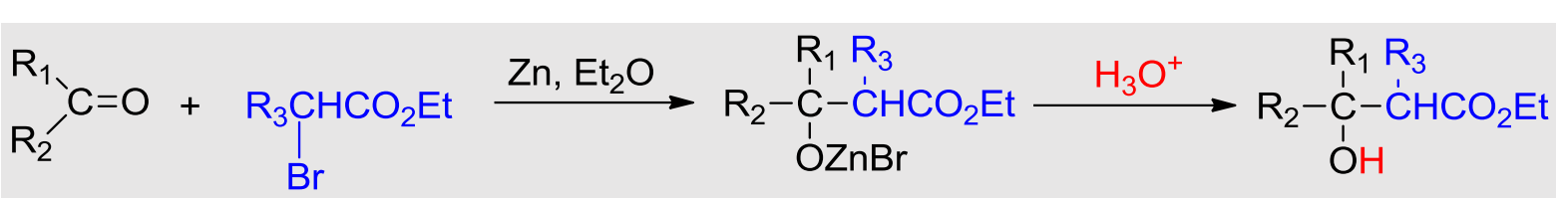
10.4.1.4 与有机锌试剂加成——Reformatsky反应
Reformatsky反应
- 亲核试剂:\(\ce{R1C^-HCO2R2}\)
- 亲核性:弱
- 立体化学:
反应如下:
用途:合成\(\beta\)-羟基酸和\(\alpha,\beta\)-不饱和脂肪酸酯的重要方法。
Reformatsky反应可以借助\(\ce{Zn}\)将\(\alpha\)-卤代酸酯加成到醛或者酮的羰基上。
由于形成的有机锌化物的亲核性并不强,其只与反应活性强的羰基反应,而不会打酯基上羰基的主意。
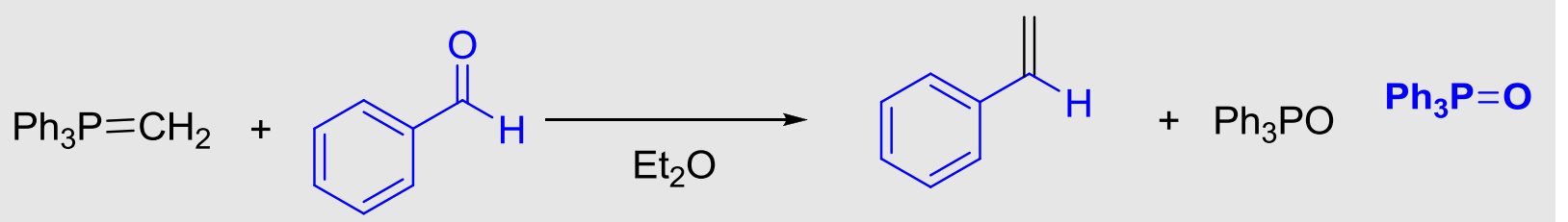
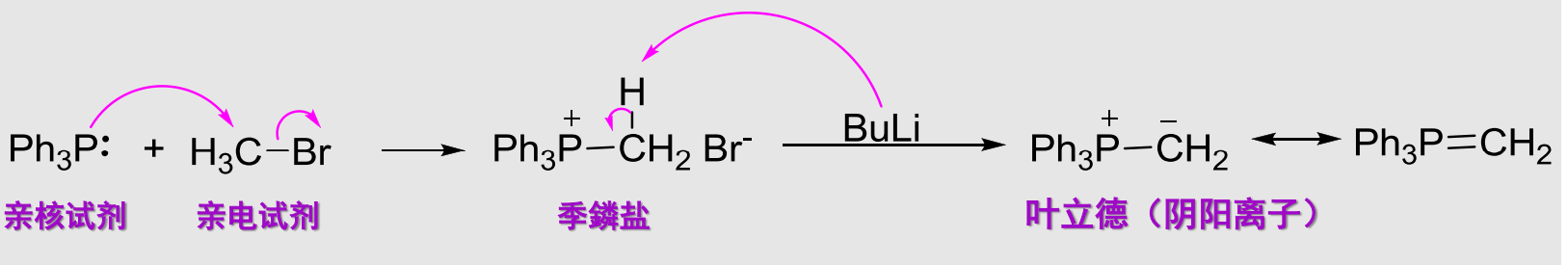
10.4.1.5 与磷叶立德试剂加成——Witting反应
Witting反应
- 亲核试剂:\(\ce{Ph3P=CH2}\)
- 亲核性:
- 立体化学:
反应如下:
用途:将醛或酮上的羰基氧替换为双键碳。
磷叶立德试剂的制备反应如下:
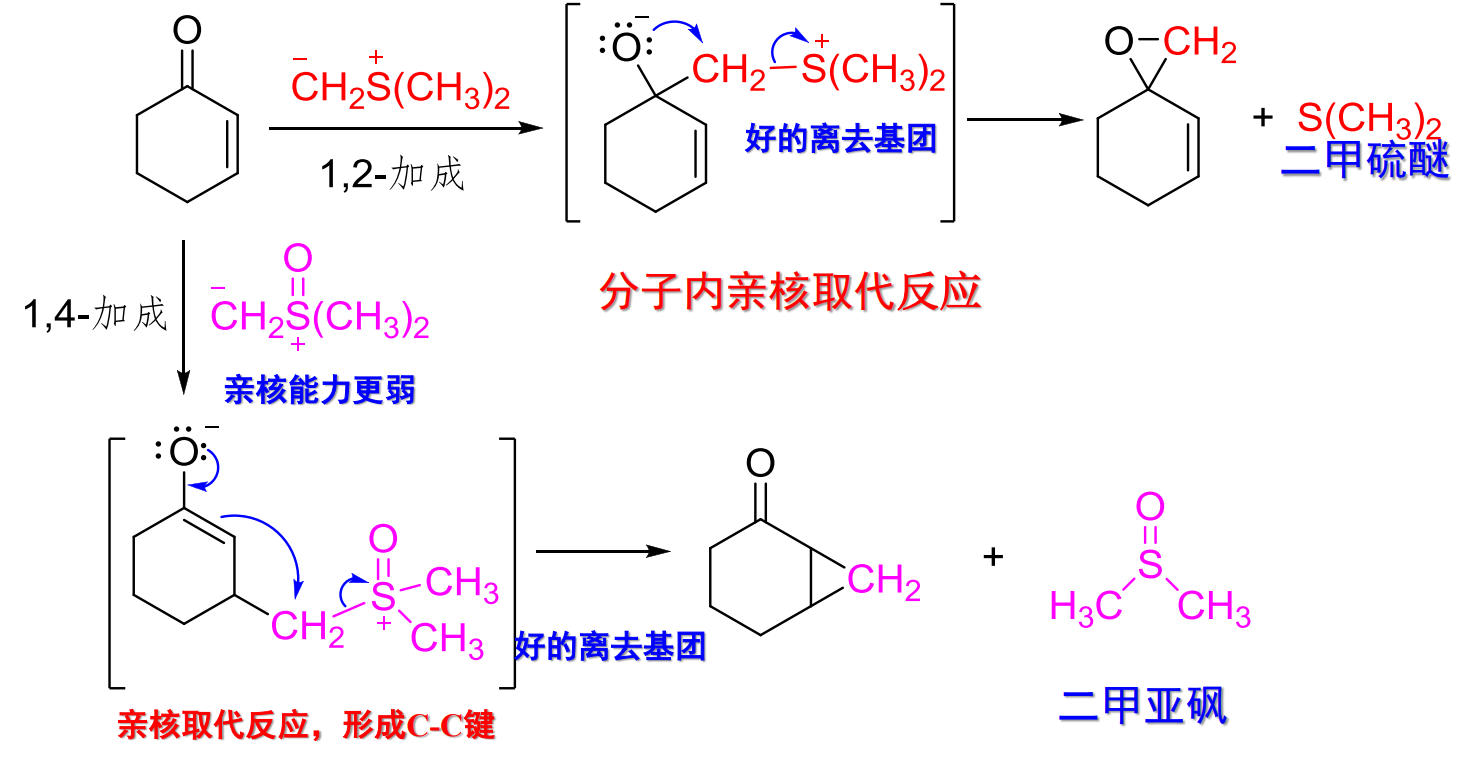
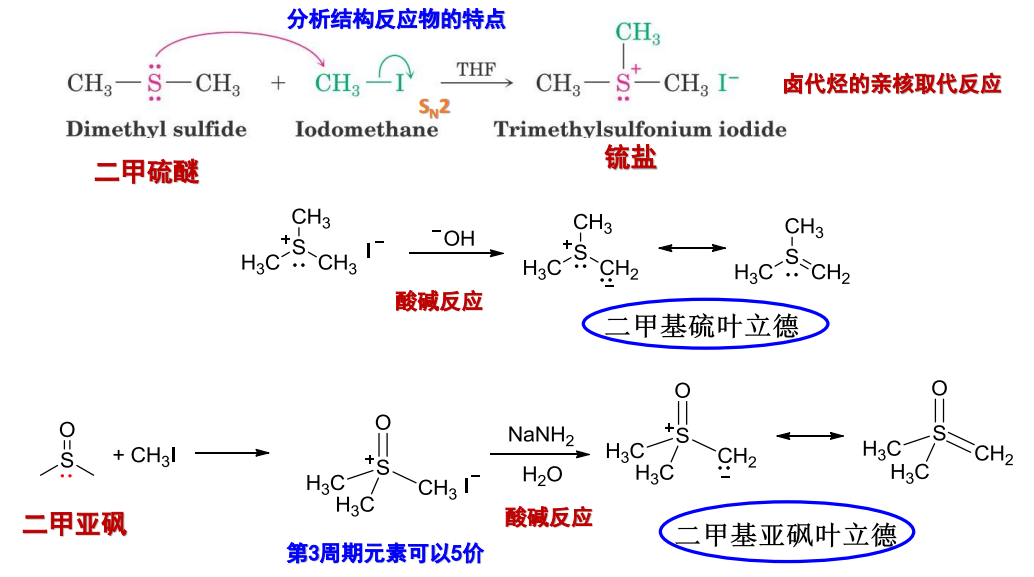
10.4.1.6 与硫叶立德试剂加成
与硫叶立德试剂加成
- 亲核试剂:\(\ce{\overset{-}{C}H2\overset{+}{S}(CH3)2}\)、\(\ce{\overset{-}{C}H2\overset{+}{S}O(CH3)2}\)
- 亲核性:
- 立体化学:
反应如下:
用途:
二甲基硫叶立德和二甲基亚砜叶立德的制备方式如下:
10.4.2 与含氧亲核试剂的加成
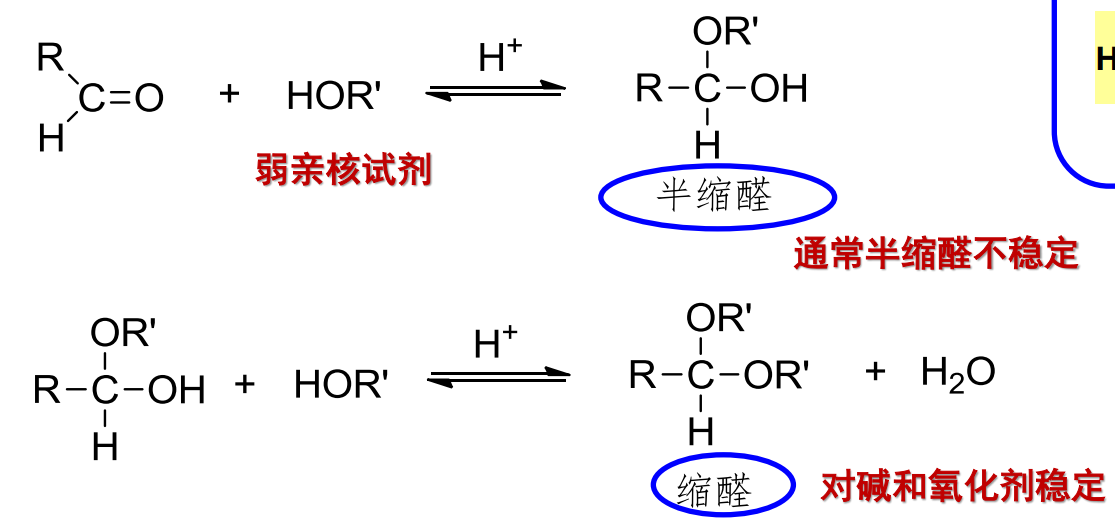
10.4.2.1 与醇反应
与醇的缩合反应
- 亲核试剂:\(\ce{ROH}\)
- 亲核性:弱
- 立体化学:
反应如下:
用途:
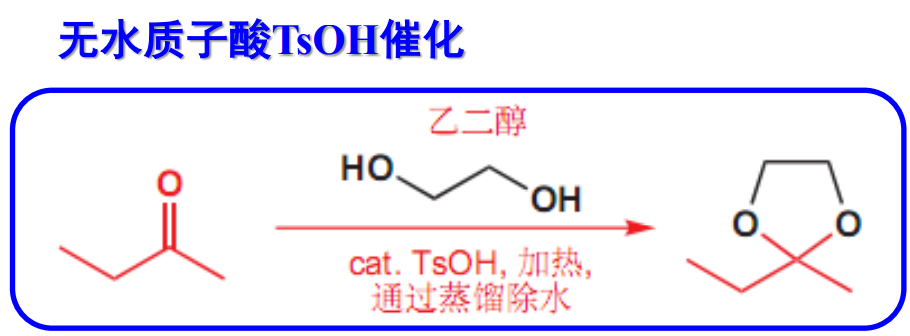
该反应主要在干燥的氯化氢气体,或无水强酸——对甲苯磺酸(TsOH)的催化下进行,一般分为两步:第一步形成稳定性不高的半缩醛,第二步生成稳定性更好的缩醛。
酮的反应活性不高,缩酮较缩醛更难形成。
两步反应的机理如下:
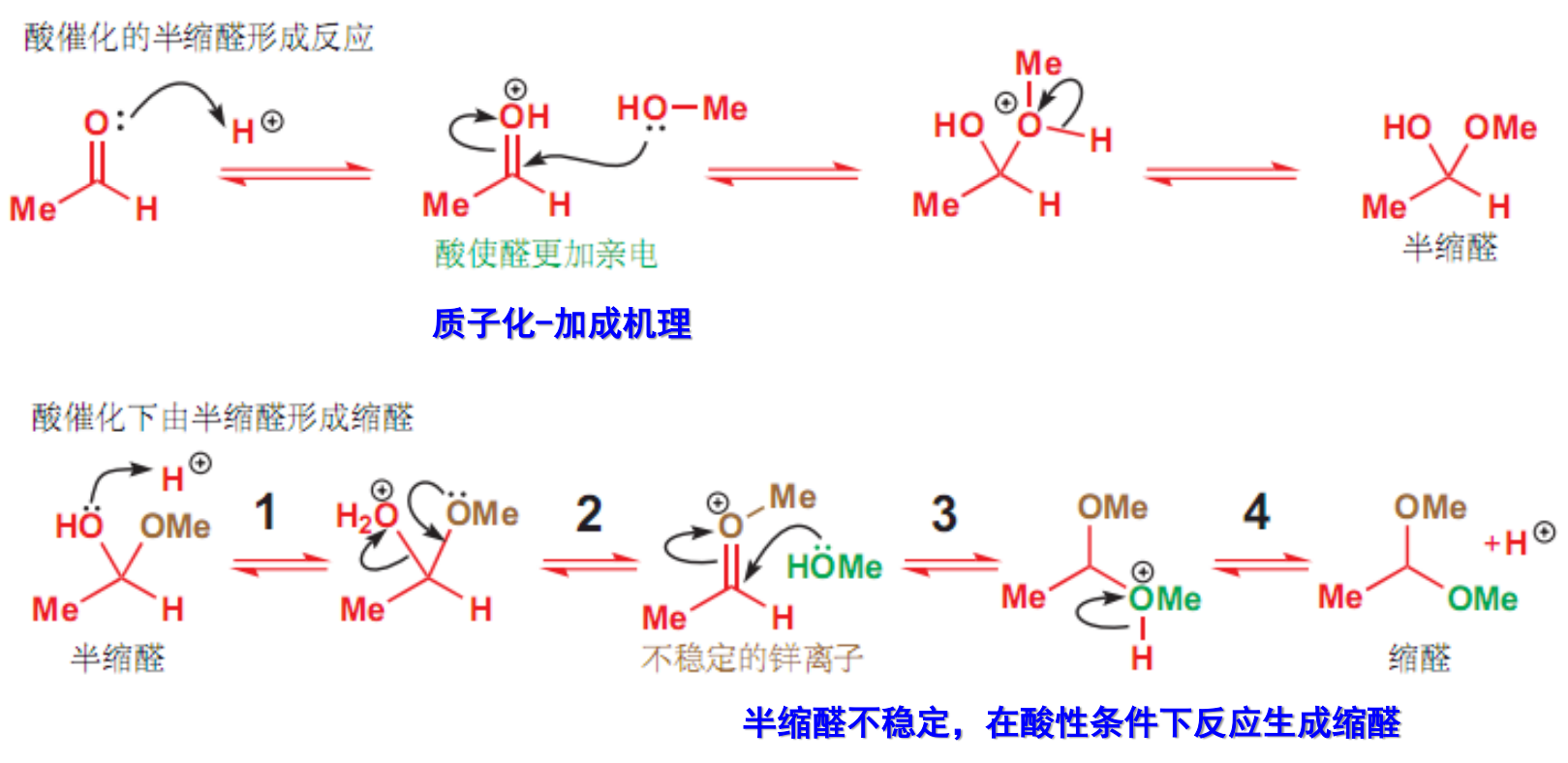
特别地,这个反应可逆,如下:
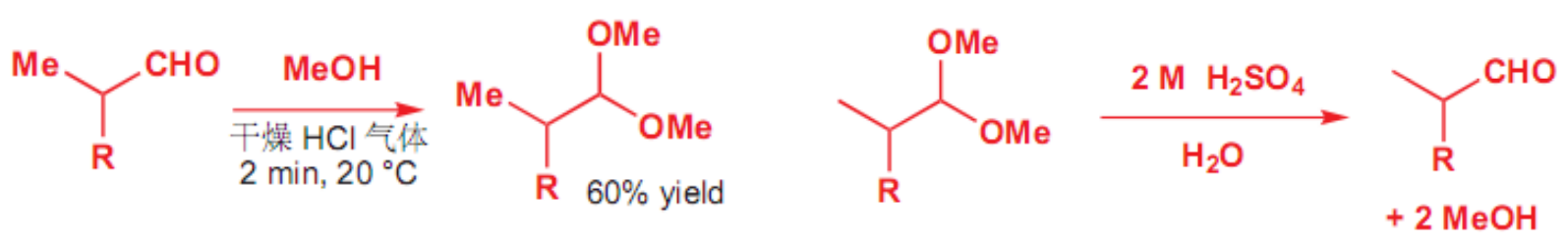
于是其有一个很重要的用途:保护醛基。
同样的,硫醇在Lewis酸催化下可以与醛、酮发生反应:
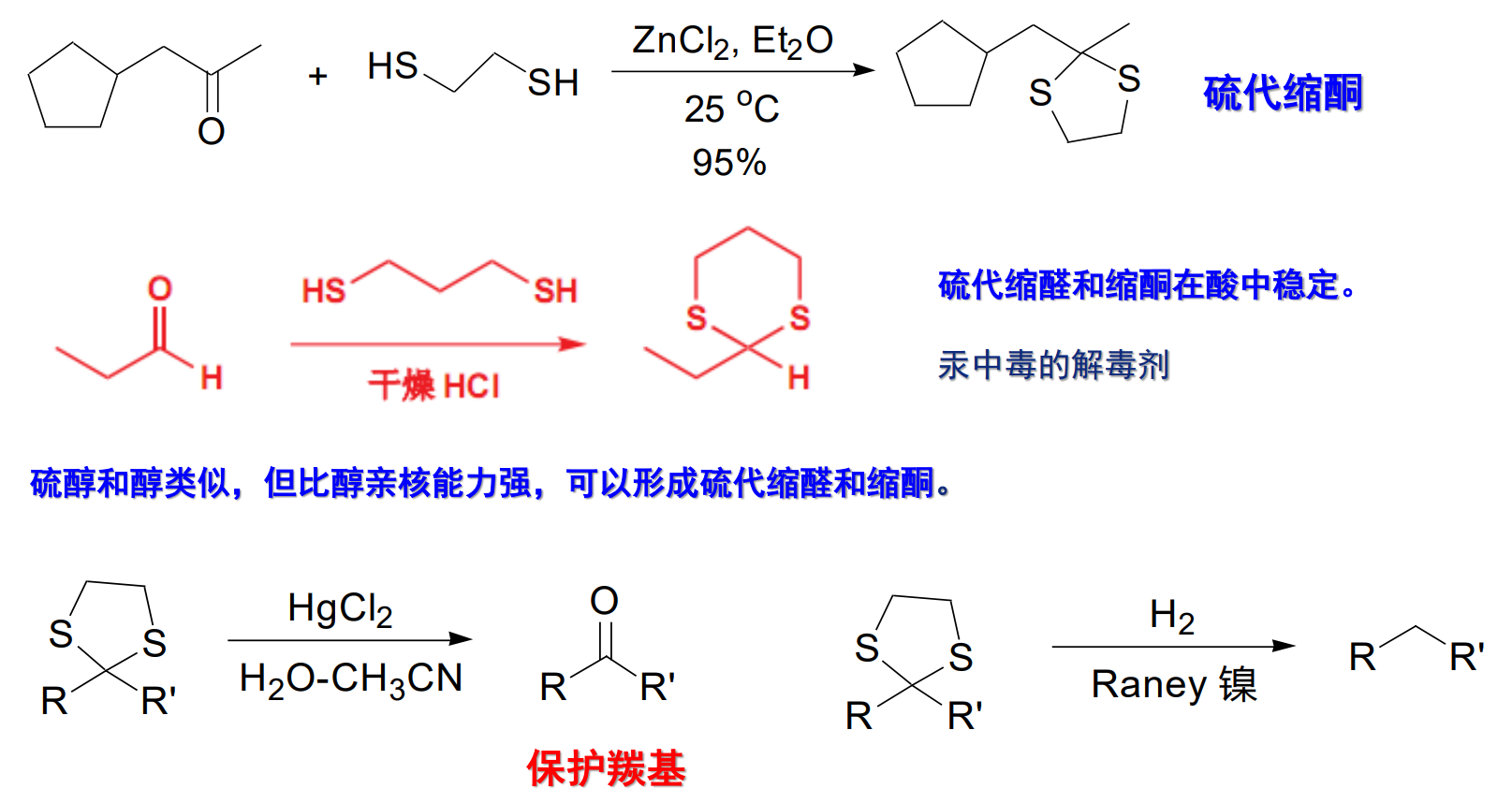
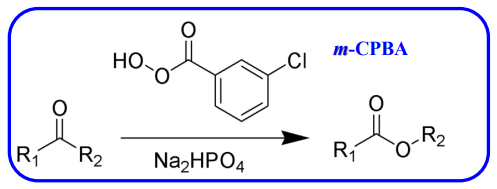
10.4.2.2 与过氧酸反应——Baryer-Villiger氧化
与过氧酸反应
- 亲核试剂:过氧酸(m_CPBA)
- 亲核性:
- 立体化学:构型保持
- 有区域选择性(基团迁移)
反应举例如下:
该反应的反应机理为:
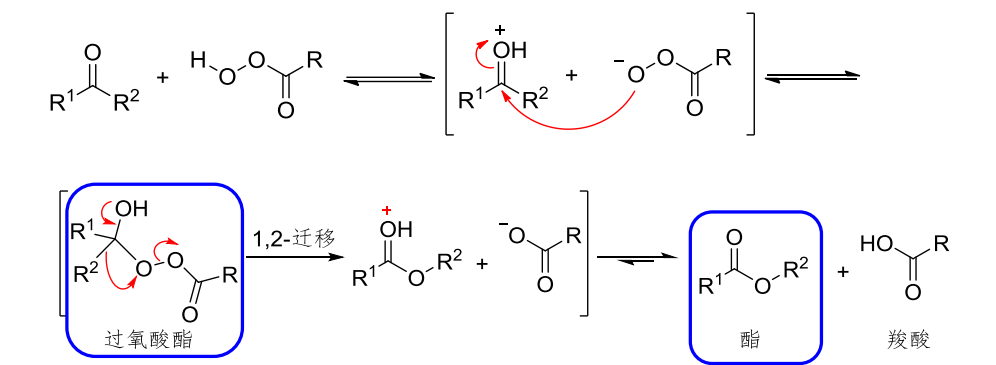
特别的,如果被进攻的羰基左右不对称,该反应会表现出区域选择性,也就是对迁移基团的偏好。
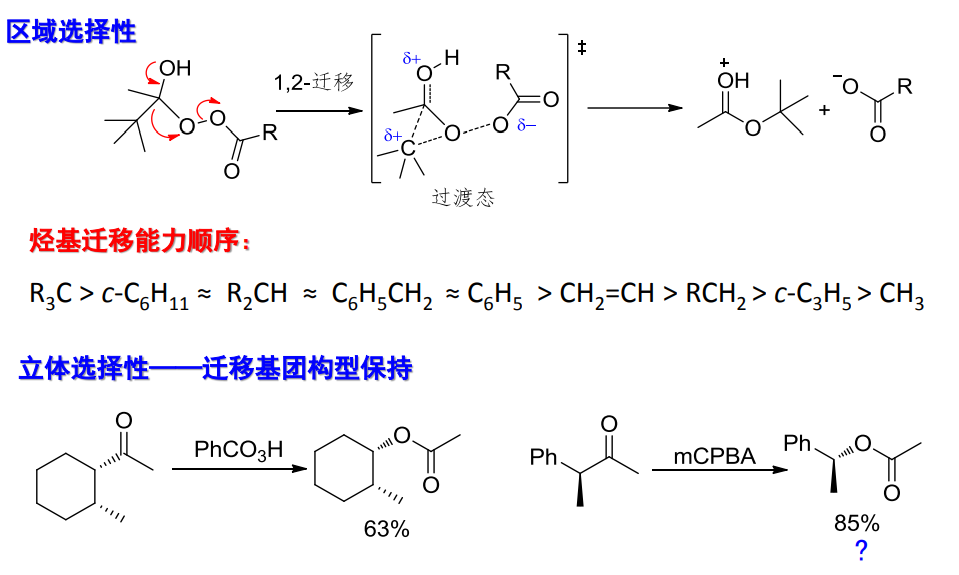
值得注意的是,在立体选择性上,醛/酮与过氧酸的加成会保持迁移基团上原先手性碳的构型。
特别地,醛与过氧酸反应,迁移的基团为\(\ce{H}\)(其为s轨道,无取向要求,体积小),产物为羧酸。但是由于过氧酸不算便宜,且有很多廉价氧化剂可以将醛氧化为羧酸,所以这个反应在醛上出现较少。
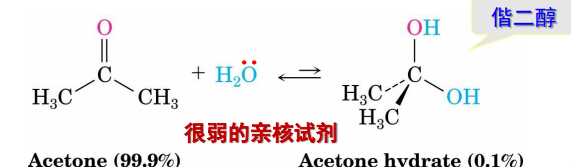
10.4.2.3 与水加成——形成水合物
与水加成
- 亲核试剂:\(\ce{H2O}\)
- 亲核性:弱
- 立体化学:无立体选择性
反应举例如下:
注意:产物为偕二醇,一般不稳定。
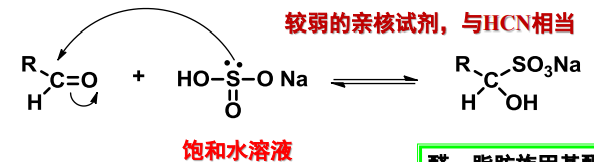
10.4.3 与含硫亲核试剂的加成
与含硫亲核试剂加成
- 亲核试剂:\(\ce{HSO4-}\)
- 亲核性:较弱,相当于\(\ce{HCN}\)
- 立体化学:无
反应举例如下:
上面反应举例的最终产物在水溶液中会形成白色沉淀,于是这个反应也可用来分离会提纯醛、脂肪族甲基酮、少于8个碳原子的脂环酮。
该反应可逆,在酸性条件下就可将分离出来沉淀重新转化为醛/酮。
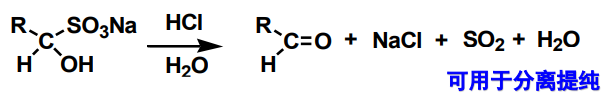
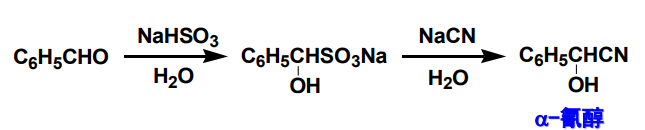
借助其的无毒性质和与氢氰酸相近的亲核性,可以通过交换反应制备\(\ce{\alpha}\)-氰醇,避免了低沸点的\(\ce{HCN}\)的使用:
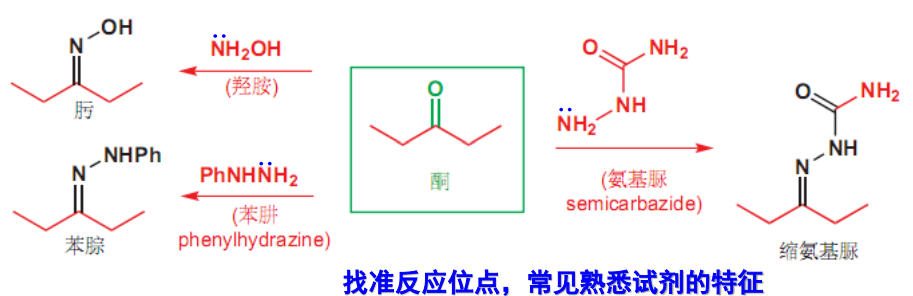
10.4.4 与含氮亲核试剂的加成
常见的含氮亲核试剂如下:
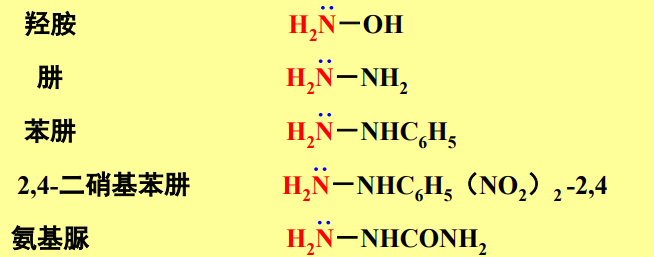
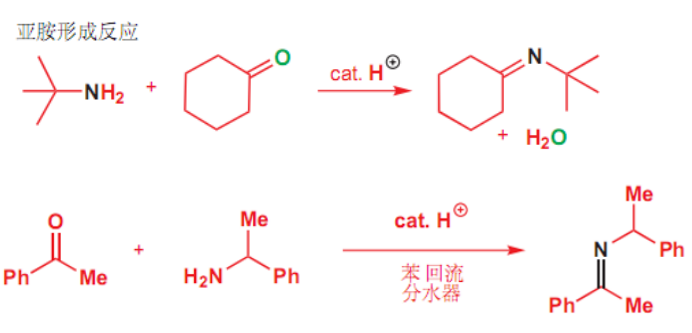
10.4.4.1 与伯胺的加成
与伯胺的加成
- 亲核试剂:\(\ce{-NH2}\)
反应举例如下:
最后生成亚胺,该反应通式为:
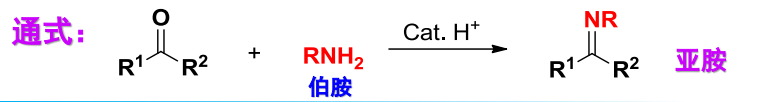
反应的机理为:
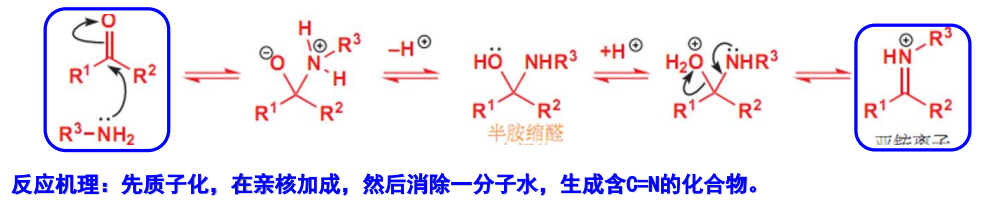
其中质子化步骤可以使羰基碳更缺电子。
10.4.4.2 与仲胺的加成
与仲胺的加成
- 亲核试剂:\(\ce{R2NH}\)
反应举例如下:
反应生成烯胺,反应通式如下:
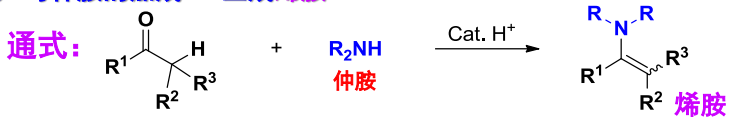
该反应也可逆,烯胺在稀酸条件下水解为醛/酮:
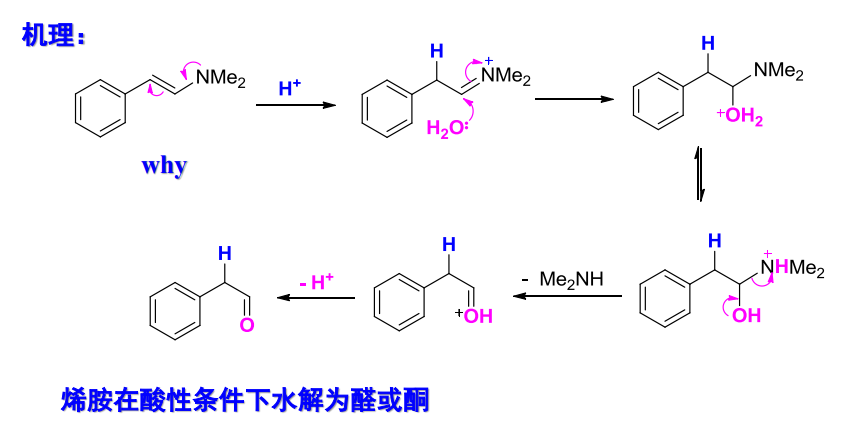
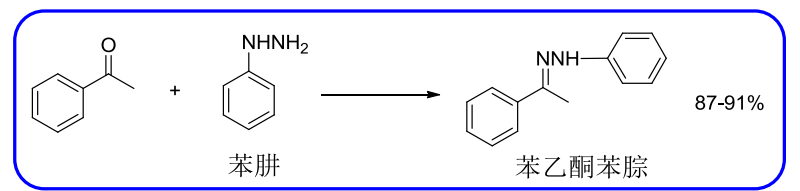
10.4.4.3 与肼等加成
与肼的加成
- 亲核试剂:\(\ce{NH2NH2、Ph-NHNH2}\)等等
反应举例如下:
这个反应看起来和醛/酮与伯胺的加成差不多。
10.4.4.4 Wolff-Kishner-黄鸣龙还原
英文名字太难记了,我们管它叫黄鸣龙还原吧。
黄鸣龙还原
- 反应条件:肼、强碱、高沸点溶剂和加热。
反应举例如下:
这个反应的机理为;
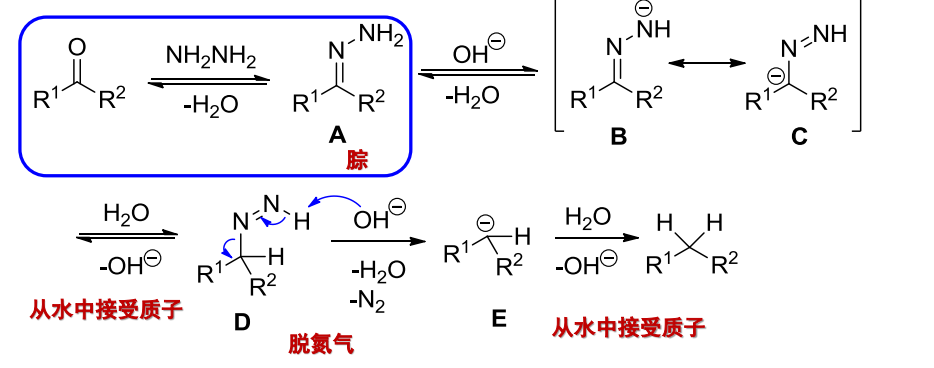
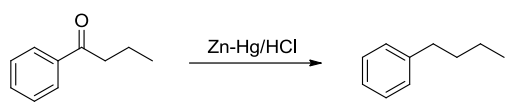
10.4.4.5 Clemmensen还原
Clemmensen还原
- 反应条件:\(\ce{Zn-Hg、HCl}\)
反应举例如下:
特别地,Clemmensen还原在酸性条件下还原羰基为亚甲基,黄鸣龙还原在碱性条件下还原羰基为亚甲基,两者互为补充,如何使用需要考虑反应物对酸碱是否敏感。
比如缩醛在酸性条件下会水解,最好使用黄鸣龙还原,而卤代烃在碱性条件下会水解,最好使用Clemmensen还原。
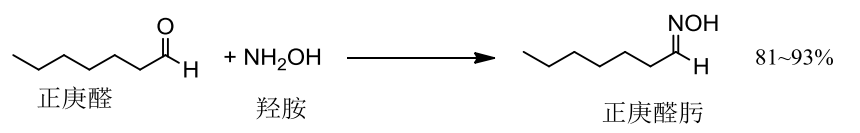
10.4.4.6 与羟胺的加成
与羟胺的加成
- 亲核试剂:\(\ce{NH2OH}\)
反应举例如下:
该反应生成肟,在酸性条件下可以发生Beckmann重排,如下:
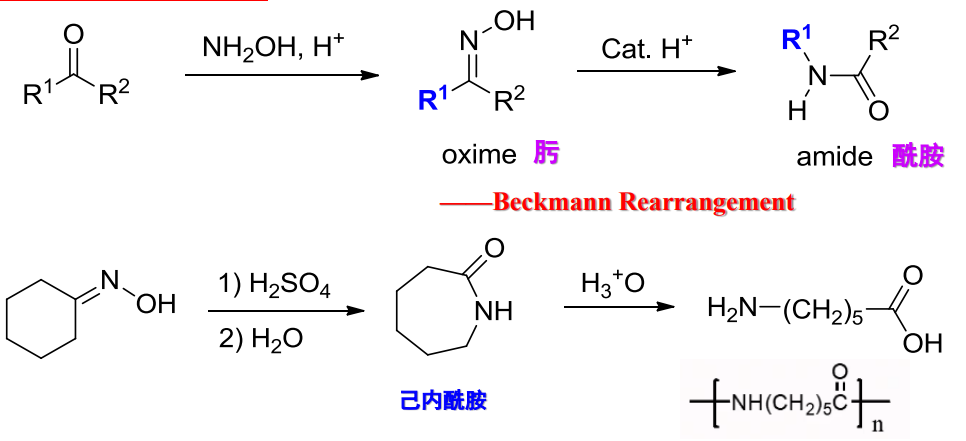
机理如下:
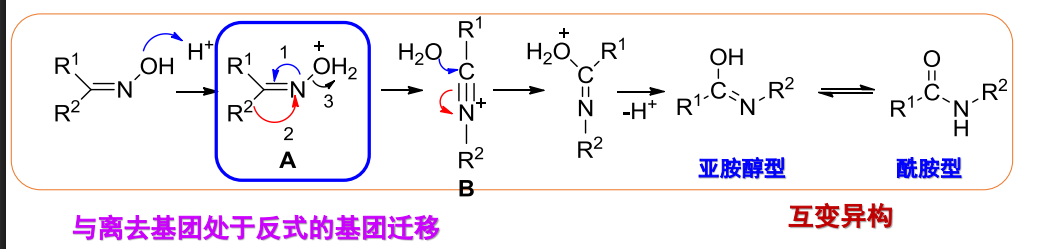
与离去基团处于反式的基团迁移,并且手性碳构型保持。
具体可见第十一章的酰胺合成。
此处简单总结一下前面的含氮亲核试剂的加成:
10.4.5 与负氢试剂的加成
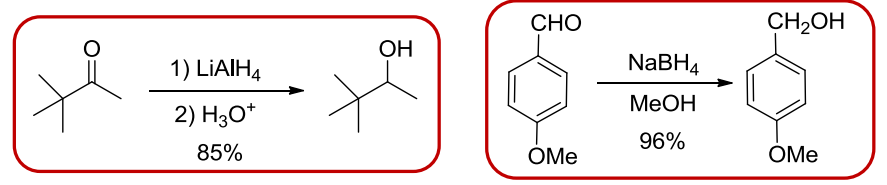
10.4.5.1 与金属氢化物的加成
与金属氢化物的加成
- 还原剂:\(\ce{NaBH4、LiAlH4}\)等等
反应举例如下:
其反应机理如下:
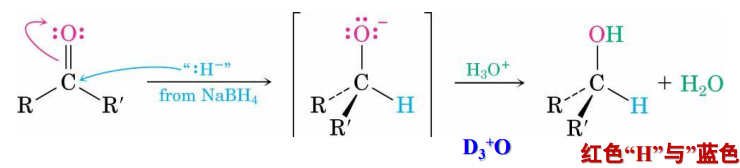
\(\ce{NaH、LiH}\)碱性很强,与\(\ce{AlH3、BH3}\)结合可以降低其碱性,提高亲核能力。
其中\(\ce{LiAlH4}\)还原性贼强,除了醛酮的羰基,\(\ce{-CO2R、-CO2H、-CN、-NO2}\)都可以被还原,但是碳碳重键不被还原。
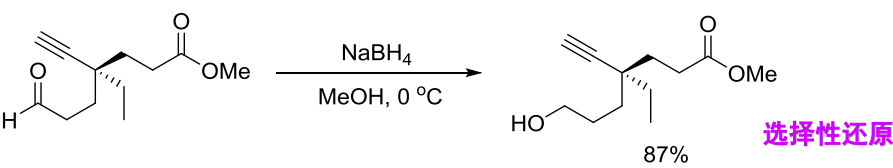
\(\ce{NaBH4}\)还原能力弱,只还原醛酮的羰基,选择性好。
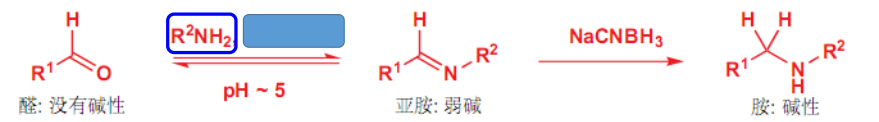
补充:\(\ce{Na(CN)BH3}\)可以将亚胺(席夫碱)还原为胺。
搭配氢气高压还原也可以:
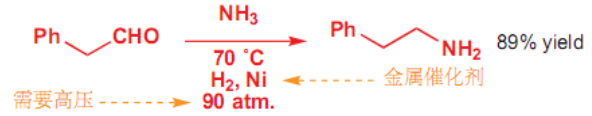
10.4.5.2 与氢转移试剂的加成
Meerwein-Ponndorf还原
- 还原剂:\(\ce{Al(OPr-i)3}\)
反应举例如下:
反应机理如下:
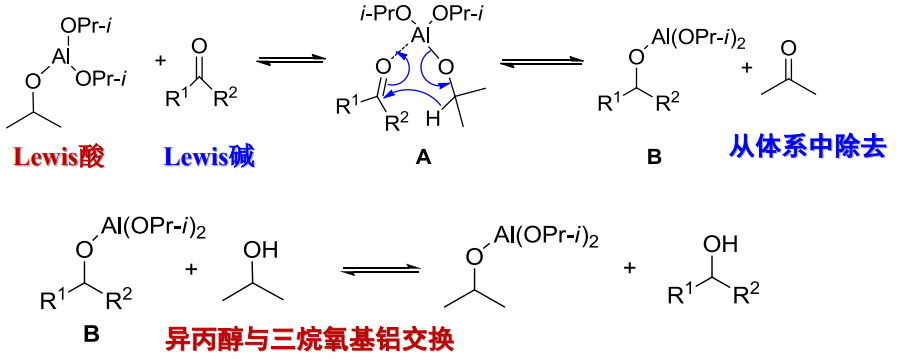
本质上是醛/酮可被异丙醇还原为醇,可当做羰基氧和羟基交换。
10.4.5.3 Cannizzaro歧化反应
Cannizzaro反应
- 反应条件:\(\ce{NaOH、KOH}\)等浓碱。
- 区域选择性:活泼羰基者最终生成羧基,不活泼者生成醇。
反应举例如下:
反应机理如下:
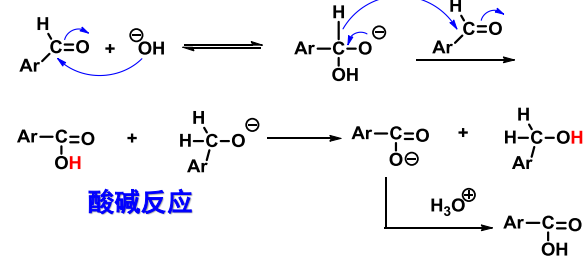
注意,这个反应仅适用于无\(\ce{\alpha-H}\)的醛。
两个不同的无\(\ce{\alpha-H}\)醛之间存在区域选择性,发生交叉Cannizzaro反应:
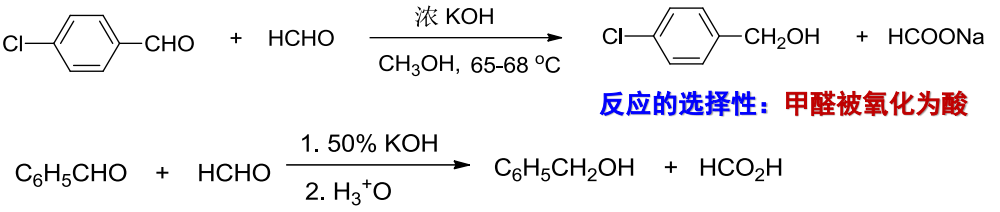
甲醛的羰基碳反应活性更高,率先被羟基亲核进攻。
10.5 醛/酮其他反应
10.5.1 醛和酮的金属还原
碱金属还原性强,可以将醛/酮的羰基还原为羟基,碱土金属还原性弱,反应时候发生两个反应产物的二聚,最终形成对称的邻二醇,称为频哪醇反应。
常用金属还原剂还原性如下:
醛酮与锌可以发生Clemmensen还原。
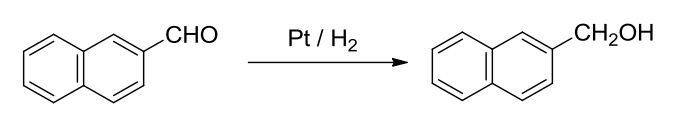
10.5.2 醛酮的催化氢化
催化氢化反应
- 还原条件:\(\ce{Pt/H2}\)
反应举例如下:
催化剂可以用\(\ce{Pt、Ni}\),可还原醛、酮、碳碳重键、氰基、硝基。
醛可以被弱氧化剂氧化,比如Tollens试剂\(\ce{Ag+(NH3)2}\)、Fehling试剂\(\ce{Cu^{2+}}\),但酮不行。
10.5.3 补充