第五章 自由基反应
5.1 自由基产生
自由基
分子在光、热等条件下因共价键发生均裂而形成的具有未成对电子的物种(原子或基团)
自由基由于具有一个未成对电子,具有较强的反应活性(它非常想稳定住自己的未成对电子)。
5.1.1 σ键的均裂
按照断裂的诱因可以将其分为两类:
- 光反应:\(\sigma\)键中一个电子跃迁到了能量较高的\(\sigma^*\)轨道
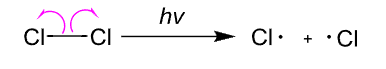
- 热反应:热解(这种一般发生在\(\sigma\)键比较弱或者生成的自由基会比较稳定的情况下)
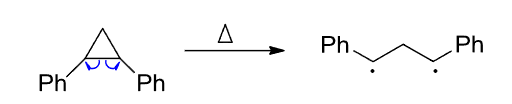
无论如何,自由基一般都由弱键的均裂形成。
自由基引发剂
一般指的是那些容易产生自由基的,引发体系内自由基反应的物质
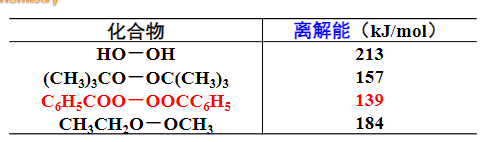
这里我们必须引入离解能的概念:
离解能
就是分子中的键能,即在分子中某一键断裂时所需的能量
如果化合物中又某个键离解能特别小,其就更容易发生均裂:
5.1.2 π键的光化学激发
原理示意如下:
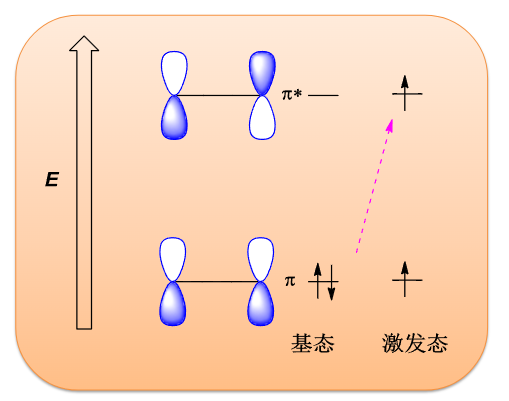
类似\(\sigma\)键的光反应,\(\pi\)键同样可以被光子激发,使得\(\pi\)电子跃迁至反键轨道上。
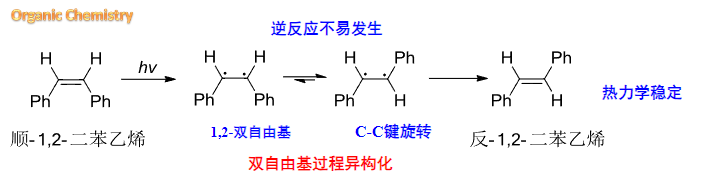
以上反应体现了热力学控制的过程,其在生物体中就有重要的作用,比如我们的视网膜上就有视黄醇衍生物发生这个反应。
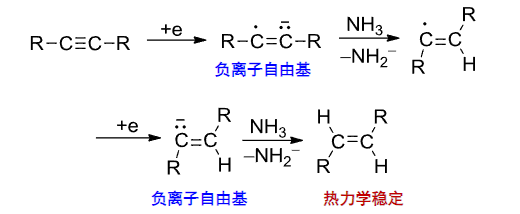
5.1.3 单电子转移(SET)——氧化还原
此反应的原理就是将强还原剂上高能量的电子丢到低能量的\(\pi^*\)轨道上,使得\(\pi\)键断开。
5.2 自由基结构及稳定性
一般来说,中心原子电负性越大,能量就越高,导致形成的自由基稳定性更差。
其具体反映在了解离能上,一个键的解离能越高,断开时候吸收的能量越多,产物能量越高,越不稳定。
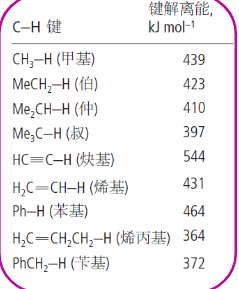
与前面所学的类似,超共轭效应、给电子共轭效应和给电子诱导效应能稳定烷基自由基。
如果有共轭效应参与其中,我们一样可以画自由基的共振式:
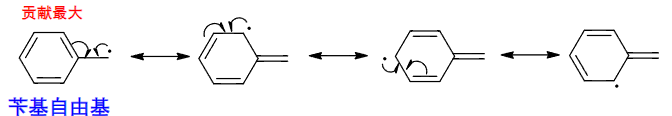
常见自由基的稳定性比较如下:
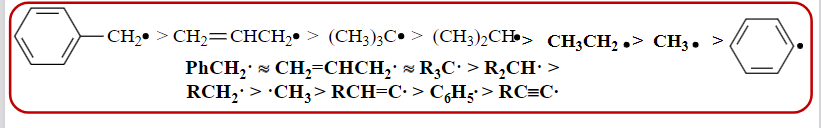
特别的,空间位阻的因素同样会影响自由基的稳定性,如果自由基的周围有大空间位阻的基团保护,其就更难参与到反应之中,反而提升了自由基的稳定性:
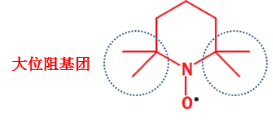
这里我们特别强调其为立体效应
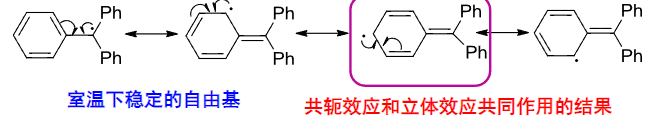
下面是一个共轭效应和立体效应共同稳定自由基的例子:
5.3 烷烃的自由基取代反应
5.3.1 甲烷的氯代反应
这个反应极其经典,研究发现光照是其引发条件,在高中时候我们就已经接触到了其的链式自由基反应
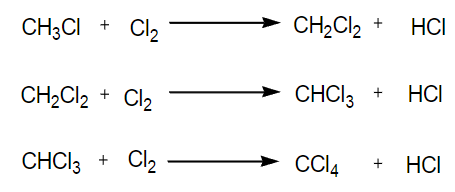
取代反应
一个原子或者基团取代了另一个原子或者基团的反应
5.3.2 氯代反应的机理
氯代反应作为典型的自由基反应,其遵循着典型的自由基反应过程,具体如下:
- 链引发:\(\ce{Cl-Cl \xrightarrow[或h\nu]{\Delta} 2Cl·}\)
- 链增长:这个过程中一个自由基消失,又产生一个新的自由基
\(\ce{Cl· + CH4 -> CH3· + HCl}\) - 链终止:两个自由基相遇,形成不活泼的分子,比如下面这个反应:
\(\ce{Cl· + CH3· -> CH3Cl}\)
全过程就是产生自由基->未成对电子倾向成键->抢夺原子->产生新的自由基->自由基相互反应终止。
我们的自由基反应真是公公又式式啊。
以上氯代反应的反应势能图如下:
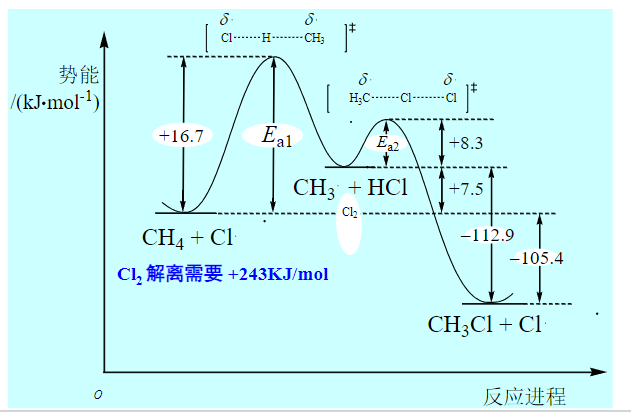
5.3.3 其他卤素的卤代反应
先说结论:
- 氟化反应难以控制。
- 碘化反应一般不用。碘自由基是不活泼的自由基。
- 氯化和溴化反应常用,氯化比溴化反应快5万倍
原因可见下表(特别关注活化能):

5.3.4 其他烷烃的卤化反应
对于更加复杂的烷烃,其上可能存在多个卤代位点,那么其选择性是如何确定的呢?
依然是那句话:中间产物越稳定,该反应途径越容易进行
\(\ce{Br}\)的选择性特别好,我们以它举例:
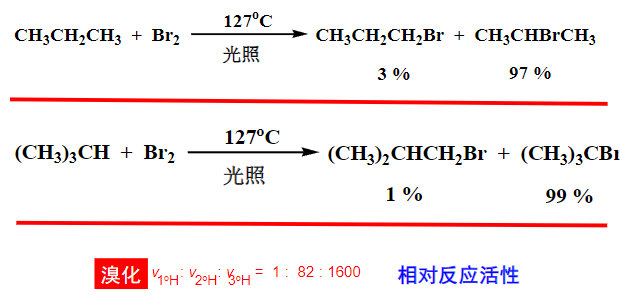
可以看到,不同碳上形成自由基的中间体的稳定性决定了最后产物的占比。
至于氯……它的选择性令人难蚌:
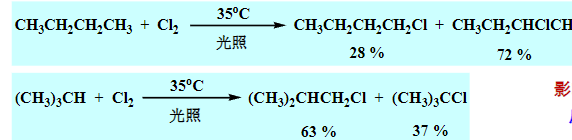
不过总的来说,大方向上,中间产物越稳定,最后的相应产物就越容易得到。
\(\ce{Cl}\)糟糕的选择性源于它过低的活化能,使得不同反应路径之间的选择不够明显。
5.4 不饱和烃的α-H卤代
为了防止混淆,这里要特别与上一章的加成区别开来,取代的反应条件是不同的,其一般是气相条件、高温、自由基引发。
也有烷基苯的α-H卤代:
双键的α-H卤代
特别提一下这个双键的卤代反应,其和我们之前学到得双键在NBS下发生与卤素的加成反应十分相似,不过具体的区别是:
- 这里在非极性溶剂的体系下反应,不利于溴𬭩阳离子的形成。
- NBS主要生成溴自由基
5.5 自由基加成反应
探讨加成之前,我们必须再次强调:
自由基卤代的反应条件通常是:高温、光照、自由基引发剂、低浓度等
5.5.1 烯烃的自由基加成反应
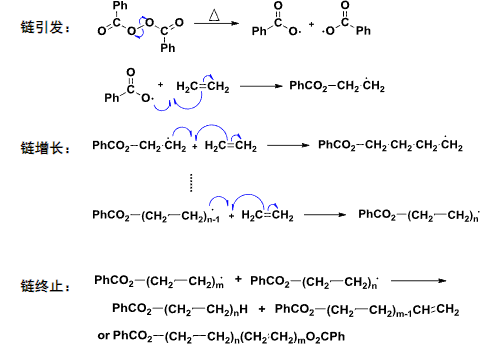
首要的是有一个自由基引发剂(通常是过氧化物),然后引发加成的反应试剂产生自由基。
具体的反应过程如下:
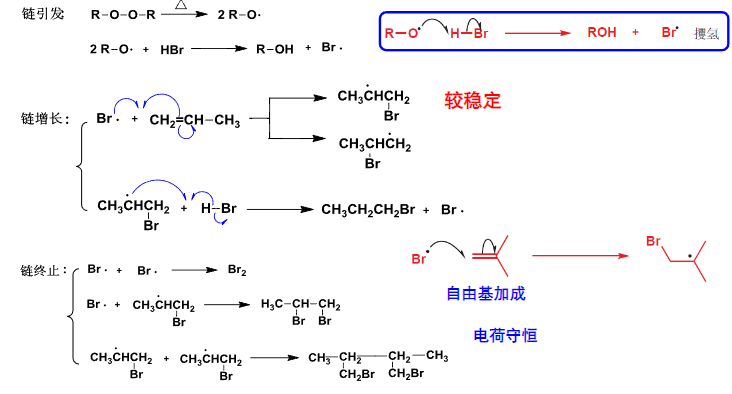
5.5.2 自由基聚合反应